Fluoruro de potasio (KF): estructura, propiedades y usos
El fluoruro de potasio es un halogenuro inorgánico que consiste en una sal formada entre el metal y el halógeno. Su fórmula química es KF, lo que significa que por cada catión K+ hay un F– de contraparte. Como puede verse, las interacciones son electrostáticas, y a consecuencia de ello no existen enlaces covalentes K-F.
Esta sal se caracteriza por su extrema solubilidad en agua, por lo que forma hidratos, absorbe humedad y es delicuescente. Por lo tanto es muy fácil preparar soluciones acuosas de ella, las cuales sirven como fuente de aniones fluoruros para todas aquellas síntesis donde se desea incorporarlo a alguna estructura.
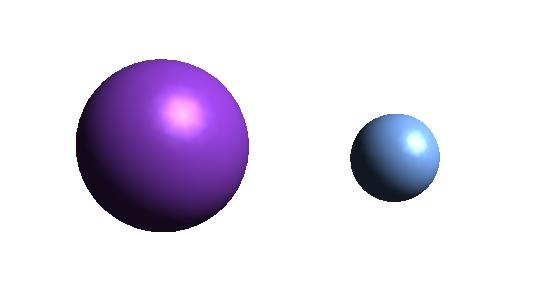
Arriba se muestra el catión K+ (esfera morada) y el anión F– (esfera azulada). Ambos iones interaccionan atrayéndose mutuamente por sus cargas +1 y -1.
Aunque el KF no sea tan peligroso como el HF, el hecho de que tenga en “total libertad” al anión F–, lo vuelve una sal tóxica. Por eso sus soluciones han sido utilizadas como insecticidas.
El KI se produce haciendo reaccionar el carbonato de potasio con el ácido fluorhídrico, produciéndose el bifluoruro de potasio (KHF2); el cual por descomposición térmica termina originando el fluoruro de potasio.
Índice del artículo
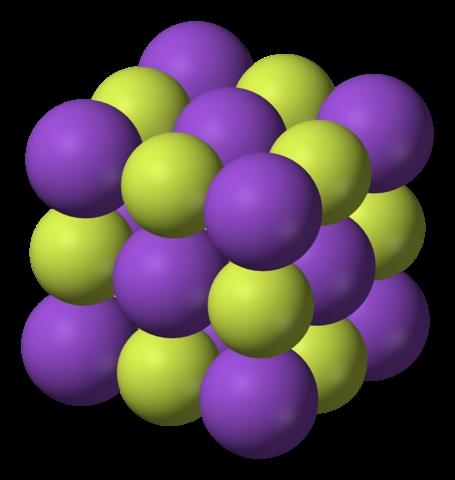
En la imagen superior se muestra la estructura del fluoruro de potasio. Las esferas moradas, al igual que en la primera imagen, representan los cationes K+; mientras que las esferas amarillentas representan los aniones F–.
Nótese que el arreglo es cúbico y corresponde a una estructura tipo sal gema, muy similar a la del cloruro de sodio. Todas las esferas se encuentran rodeadas por seis vecinos, los cuales conforman un octaedro KF6 o FK6; es decir, cada K+ se rodea de seis F–, y lo mismo ocurre en viceversa.
Se mencionó anteriormente que el KF es higroscópico y por tanto absorbe humedad del ambiente. Siendo así, el arreglo mostrado correspondería a la forma anhidra (sin agua) y no a sus hidratos; los cuales, absorben tanta agua que llegan incluso a solubilizarse y “derretirse” (delicuescencia).
Las estructuras cristalinas de los hidratos se tornan menos simples. ¿Por qué? Porque ahora las moléculas de agua intervienen directamente en los arreglos e interactúan con los iones K+ y F–. Unos de los hidratos más estables son el KF·2H2O y KF·4H2O.
En ambos hidratos los octaedros recién mencionados se deforman a causa de las moléculas de agua. Esto se debe principalmente a los puentes de hidrógeno entre el F– y el H2O (F–—HOH). Estudios cristalográficos han determinado que pese a esto los dos iones siguen manteniendo el mismo número de vecinos.
Como resultado de todo esto, la estructura original cúbica para el fluoruro de potasio anhidro, se transforma en un arreglo monoclínico y hasta romboédrico.
Los anhidros comparten la propiedad delicuescente, por lo que sus cristales blancos si se dejaran al contacto de una fría bruma se tornarían acuosos en poco tiempo.
58,097 g/mol.
Cristales cúbicos blancos o polvo blanco cristalino delicuescente.
Sabor salino agudo.
2.741 ºF a 760 mmHg (1502 ºC). En estado líquido se vuelve conductor de la electricidad, aunque puede que los aniones F– no colaboren en igual grado a la conducción que el K+.
1.576 ºF; 858 ºC; 1131 K (KF anhidro). Esto es indicativo de sus fuertes enlaces iónicos.
Soluble en HF, pero insoluble en alcohol. Esto demuestra que los puentes de hidrógeno entre el fluoruro y los alcoholes, F–—HOR, no favorecen el proceso de solvatación frente a la disolución de su red cristalina.
Anhidro 92 g/100 ml (18 ºC); 102 g/100 ml (25 ºC); dihidratado 349,3 g/100 ml (18 ºC). Es decir, a medida que se hidrata el KF, se vuelve más soluble en agua.
2,48 g/cm3.
100 kPa (750 mmHg) a 1.499 ºC.
Cuando es calentado a descomposición emite un humo tóxico de óxido de potasio y fluoruro de hidrógeno.
Una solución acuosa corroe el vidrio y la porcelana.
No es una sustancia inflamable
1.363.
Estable si se protege de la humedad, ya que de lo contrario se disuelve el sólido. Incompatible con ácidos y bases fuertes.
Las soluciones acuosas de fluoruro de potasio se usan en aplicaciones y procesos industriales; por ejemplo, las soluciones de KF permiten ajustar el pH en las manufacturas que se realizan en las instalaciones de procesamiento de textiles y en las lavanderías (lo aproximan a un valor de 7).
El fluoruro de potasio es después del fluoruro de hidrógeno, la fuente principal de obtención del flúor. Este elemento es utilizado en las plantas nucleares y en la producción de compuestos inorgánicos y orgánicos, algunos con usos tales como su incorporación en dentríficos.
El fluoruro de potasio puede emplearse en la síntesis del fluorcarbono o fluorcarburo a partir del clorocarbono, mediante el empleo de la reacción de Finkeistein. En esta reacción se usan como solventes el etilenglicol y el dimetilsulfóxido.
Como es una fuente de flúor donde yace disuelto en agua, a partir de sus soluciones pueden sintetizarse fluoruros complejos; es decir, se les incorpora un F– a las estructuras. Un ejemplo se tiene en la siguiente ecuación química:
MnBr2(ac) + 3KF(ac) => KMnF3(s) + 2KBr(ac)
Precipita entonces el fluoruro mixto de KMnF3. Así, pudiera agregarse F– para que forme parte de una sal metálica compleja. Además del manganeso, puede precipitarse fluoruros de otros metales: KCoF3, KFeF3, KNiF3, KCuF3 y KZnF3.
Asimismo, el flúor puede incorporarse covalentemente a un anillo aromático, sintetizándose organofluorados.
El KF se utiliza como material intermedio o crudo para la síntesis de compuestos que se usan principalmente en la agroquímica o productos pesticidas.
Además, se utiliza como agente fundente de soldaduras y en el grabado de vidrios; es decir, su solución acuosa carcome la superficie del vidrio y, sobre un molde, imprime el acabado deseado.
- Chemical Book. (2017). Potassium fluoride. Recuperado de: chemicalbook.com
- PubChem. (2019). Potassium fluoride. Recuperado de: pubchem.ncbi.nlm.nih.gov
- T. H. Anderson and E. C. Lincafelte. (1951). The structure of potassium fluoride dihydrate. Acta Cryst. 4, 181.
- Royal Society of Chemistry. (2015). Potassium fluoride. ChemSpider. Recuperado de: chemspider.com
- Maquimex. (s.f.). Fluoruro de potasio. Recuperado de: maquimex.com
