Ácido fluorhídrico (HF): estructura, propiedades y usos
¿Qué es el ácido fluorhídrico?
El ácido fluorhídrico (HF) es una solución acuosa en la que está disuelto el fluoruro de hidrógeno. Este ácido es obtenido principalmente de la reacción del ácido sulfúrico concentrado con el mineral fluorita (CaF2). El mineral se degrada por la acción del ácido y el agua remanente disuelve los gases de fluoruro de hidrógeno.
A partir de esta misma agua ácida puede destilarse el producto puro, es decir, el fluoruro de hidrógeno anhídrido. Dependiendo de las cantidades del gas disuelto se obtienen distintas concentraciones y, por lo tanto, varios productos disponibles del ácido fluorhídrico en el mercado.
A una concentración menor al 40 %, tiene una apariencia cristalina indistinguible del agua, pero a mayores concentraciones despide vapores blancos de fluoruro de hidrógeno. El ácido fluorhídrico es conocido como una de las sustancias químicas más agresivas y peligrosas.
Es capaz de “comerse” casi cualquier material con el que tenga contacto: desde vidrios, cerámicas y metales, hasta rocas y concretos. ¿En qué recipiente entonces es almacenado? En botellas de plástico, polímeros sintéticos inertes a su acción.
Fórmula
La fórmula del fluoruro de hidrógeno es HF, pero la del ácido fluorhídrico se representa en un medio acuoso, HF(ac), para diferenciarse del primero.
Así, el ácido fluorhídrico puede considerarse como el hidrato del fluoruro de hidrógeno, y este resulta su anhídrido.
Estructura del ácido fluorhídrico
Todo ácido en agua tiene la capacidad de generar iones en una reacción de equilibrio. Para el caso del ácido fluorhídrico, se estima que en una solución existe el par de iones H3O+ y F–.
El anión F– probablemente forme un puente de hidrógeno muy fuerte con uno de los hidrógenos del catión (F—H-O+-H2). Esto explica por qué el ácido fluorhídrico es un ácido débil de Bronsted (donador de protones, H+), pese a su alta y peligrosa reactividad; es decir, en agua no libera tantos H+ comparado a otros ácidos (HCl, HBr o HI).
No obstante, en el ácido fluorhídrico concentrado las interacciones entre las moléculas de fluoruro de hidrógeno son lo suficientemente efectivas para permitirles escapar en fase gaseosa.
Es decir, dentro del agua estas pueden interactuar como si estuvieran en el anhídrido líquido, formando así puentes de hidrógeno entre estas. Estos puentes de hidrógeno pueden asimilarse como unas cadenas casi lineales (H-F—H-F—H-F—…) rodeadas de agua.
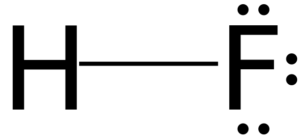
En la imagen superior, el par no compartido de electrones orientados en sentido contrario del enlace (H-F:) interacciona con otra molécula de HF para armar la cadena.
Propiedades del ácido fluorhídrico
Por ser el ácido fluorhídrico una solución acuosa, sus propiedades dependen de la concentración del anhídrido disuelto en agua. El HF es muy soluble en agua y es higroscópico, siendo capaz de producir una variedad de soluciones: desde muy concentradas (humeantes y con tonalidades amarillas) hasta muy diluidas.
A medida que disminuye su concentración, el HF(ac) adopta propiedades más similares al agua pura que los del anhídrido. Sin embargo, los puentes de hidrógeno H-F—H son más fuertes que aquellos en el agua, H2O—H-O-H.
Ambos coexisten en armonía en las soluciones, elevando los puntos de ebullición (hasta 105ºC). Igualmente, las densidades aumentan conforme más HF anhídrido es disuelto. De resto, todas las soluciones de HF(ac) tienen olores fuertes e irritantes y son incoloras.
Reactividad
Entonces, ¿a qué se debe el comportamiento corrosivo del ácido fluorhídrico? La respuesta está en el enlace H-F y en la capacidad del átomo de flúor de formar enlaces covalentes muy estables.
Al ser el flúor un átomo muy pequeño y electronegativo, es un poderoso ácido de Lewis. Es decir, se separa del hidrógeno para enlazarse a especies que le ofrezcan más electrones a un bajo costo energético. Por ejemplo, estas especies pueden ser metales, tal como el silicio presente en los vidrios.
SiO2 + 4 HF → SiF4(g) + 2 H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Si la energía de disociación del enlace H-F es alta (574 kJ/mol), ¿por qué se rompe en las reacciones? La respuesta tiene matices cinéticos, estructurales y energéticos. En general, mientras menos reactivo sea el producto resultante, más favorecida es su formación.
¿Qué ocurre con el F– en el agua? En soluciones concentradas de ácido fluorhídrico otra molécula HF puede formar puente de hidrógeno con el F– del par [H3O+F–].
Esto trae como consecuencia la generación del ion difluoruro [FHF]–, el cual es extraordinariamente ácido. Por eso todo contacto físico con este es sumamente nocivo. La más mínima exposición puede desencadenar una infinidad de daños al organismo.
Existen muchas normas y protocolos de seguridad para su adecuado manejo, y así evitar potenciales accidentes a quienes operen con este ácido.
Usos/aplicaciones del ácido fluorhídrico
Es un compuesto con numerosas aplicaciones en la industria, en la investigación y en el quehacer de los consumidores:
- El ácido fluorhídrico genera derivados orgánicos que intervienen en el proceso de purificación del aluminio.
- Se usa en la separación de isótopos del uranio, como en el caso del hexafluoruro de uranio (UF6). Asimismo, es usado en la extracción, procesamiento y refinación de metales, rocas y óleos, utilizándose también para la inhibición del crecimiento y remoción del moho.
- Las propiedades corrosivas del ácido han sido utilizadas para tallar y grabar cristales, especialmente los escarchados, mediante la técnica del aguafuerte.
- Es usado en la fabricación de semiconductores de silicón, con múltiples usos en el desarrollo de la computación y la informática, responsables del desarrollo humano.
- Es utilizado en la industria automotor como limpiador, usándose como removedor del moho en la cerámica.
- Además de servir de intermediario en algunas reacciones química, el ácido fluorhídrico es utilizado en algunos intercambiadores iónicos que intervienen en la purificación de metales y sustancias más complejas.
- Participa en el procesamiento del petróleo y sus derivados, lo cual ha permitido la obtención de solventes de uso en la fabricación de productos para la limpieza y eliminación de grasas.
- Se usa en la generación de agentes para el enchapado y tratamiento de superficies.
- Los consumidores utilizan numerosos productos en los cuales ha participado en su elaboración el ácido fluorhídrico; por ejemplo, algunos necesarios para el cuidado del automóvil, productos de limpieza para el mobiliario, componentes eléctricos y electrónicos, y combustibles, entre otros productos.
Referencias
- PubChem. (2018). Hydrofluoric Acid. Recuperado el 03 de abril de 2018, de: pubchem.ncbi.nlm.nih.gov.
- Kat Day. (16 de abril de 2013). The acid that really does eat through everything. Recuperado el 03 de abril de 2018, de: chronicleflask.com
- Wikipedia. (28 de marzo de 2018). Hydrofluoric acid. Recuperado el 03 de abril de 2018, de: en.wikipedia.org.
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición., pág. 129, 207-249, 349, 407). Mc Graw Hill.
- Hydrofluoric Acid. Musc. Medical University of South Carolina. Recuperado el 03 de abril de 2018, de: academicdepartments.musc.edu
