Ácido carboxílico: qué son, nomenclatura, estructura, propiedades, usos
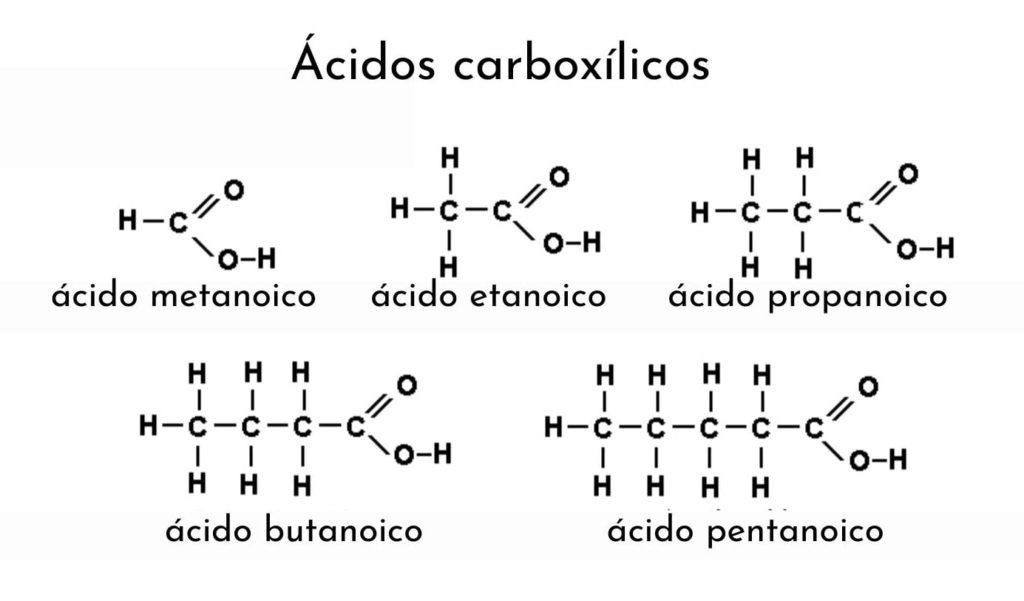
¿Qué son los ácidos carboxílicos?
El ácido carboxílico es un término que se le atribuye a cualquier compuesto orgánico que contenga un grupo carboxilo. También pueden ser denominados como ácidos orgánicos, y están presentes en muchas fuentes naturales. Por ejemplo, de las hormigas y otros insectos como el escarabajo galerita, se destila el ácido fórmico, un ácido carboxílico.
Es decir, un hormiguero es una fuente rica en ácido fórmico. También, del vinagre se extrae el ácido acético, el olor de la mantequilla rancia se debe al ácido butírico, las hierbas de valerianas contienen ácido valérico y de las alcaparras se obtiene ácido cáprico, todos estos ácidos carboxílicos.
El ácido láctico le da el mal sabor a la leche agria, y en algunas grasas y aceites están presentes los ácidos grasos. Los ejemplos de fuentes naturales de ácidos carboxílicos son innumerables, pero todos sus nombres asignados son derivados de palabras en latín. Así, en latín la palabra formica significa “hormiga”.
A medida que estos ácidos fueron extraídos en distintos capítulos de la historia, estos nombres se hicieron comunes, consolidándose en la cultura popular.
Fórmula
La fórmula general del ácido carboxílico es R–COOH, o más detalladamente: R–(C=O)–OH. El átomo de carbono está enlazado a dos átomos de oxígeno, lo que provoca un descenso en su densidad electrónica y, consecuentemente, una carga parcial positiva.
Esta carga refleja el estado de oxidación del carbono en un compuesto orgánico. En ningún otro el carbono está tan oxidado como en el caso de los ácidos carboxílicos, siendo esta oxidación proporcional al grado de reactividad del compuesto.
Por esta razón el grupo –COOH tiene predominancia frente a otros grupos orgánicos, y define la naturaleza y la cadena carbonada principal del compuesto.
De aquí que no existen derivados ácidos de las aminas (R–NH2), sino aminos derivados de los ácidos carboxílicos (aminoácidos).
Nomenclatura
Los nombres comunes derivados del latín para los ácidos carboxílicos no aclaran la estructura del compuesto, ni su arreglo o la disposición de los grupos de sus átomos.
Dada la necesidad de estas aclaraciones, surge la nomenclatura sistemática IUPAC para nombrar los ácidos carboxílicos.
Esta nomenclatura está regida por varias reglas, y algunas de estas son:
Regla 1
Para mencionar un ácido carboxílico se debe modificar el nombre de su alcano agregándole el sufijo “ico”. Así, para el etano (CH3–CH3) su correspondiente ácido carboxílico es ácido etanoico (CH3–COOH, ácido acético, el mismo del vinagre).
Otro ejemplo: para el CH3CH2CH2–COOH el alcano viene a ser butano (CH3CH2CH2CH3) y, por ende, se nombra ácido butanoico (ácido butírico, el mismo de la mantequilla rancia).
Regla 2
El grupo –COOH define la cadena principal, y el número correspondiente a cada carbono se cuenta a partir del carbonilo.
Por ejemplo, CH3CH2CH2CH2–COOH es el ácido pentanoico, contándose de uno a cinco carbonos hasta el metilo (CH3). Si otro grupo metilo está enlazado al tercer carbono, sería CH3CH2CH(CH3)CH2–COOH, siendo la nomenclatura resultante ahora: ácido 3-metilpentanoico.
Regla 3
Los sustituyentes van precedidos por el número del carbono al que están enlazados. Asimismo, estos sustituyentes pueden ser doble o triple enlaces, y agregan el sufijo “ico” por igual a los alquenos y alquinos. Por ejemplo, el CH3CH2CH2CH=CHCH2–COOH se menciona como ácido (cis o trans)3- heptenoico.
Regla 4
Cuando la cadena R consiste en un anillo (φ). Se menciona el ácido empezando por el nombre del anillo y terminando con el sufijo “carboxílico”. Por ejemplo, el φ–COOH, se nombra como ácido bencenocarboxílico.
Estructura de los ácidos carboxílicos
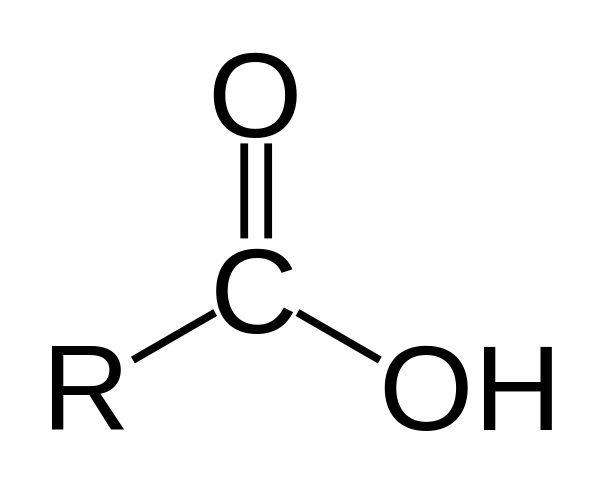
En la imagen superior está representada la estructura general del ácido carboxílico. La cadena lateral R puede ser de cualquier longitud o poseer todo tipo de sustituyentes.
El átomo de carbono tiene hibridación sp2, lo que le permite aceptar un doble enlace y generar ángulos de enlaces de aproximadamente 120º.
Por lo tanto, este grupo puede asimilarse como un triángulo plano. El oxígeno superior es rico en electrones, mientras que el hidrógeno inferior es pobre en electrones, convirtiéndose en un hidrógeno ácido (aceptor de electrones). Esto es observable en las estructuras de resonancia del doble enlace.
El hidrógeno es cedido hacia una base, y por esta razón esta estructura corresponde a un compuesto ácido.
Propiedades de los ácidos carboxílicos
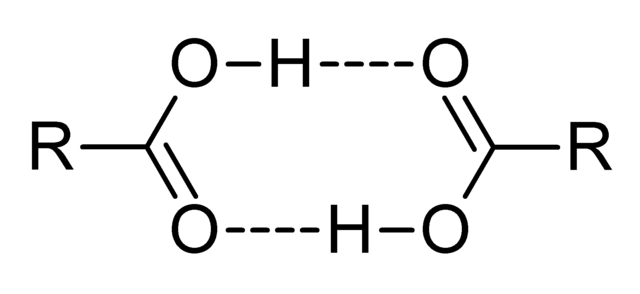
Los ácidos carboxílicos son compuestos muy polares, de olores intensos y con la facilidad de interaccionar eficazmente entre sí mediante puentes de hidrógeno, tal como ilustra la imagen superior.
Cuando dos ácidos carboxílicos interaccionan de esta manera se forman dímeros, algunos lo suficiente estables para existir en fase gaseosa.
Los puentes de hidrógeno y los dímeros ocasionan que los ácidos carboxílicos tengan puntos de ebullición más elevados que el del agua. Esto es debido a que la energía aportada en forma de calor debe evaporar no solo una molécula, sino a un dímero, enlazado además por estos puentes de hidrógeno.
Los ácidos carboxílicos pequeños sienten gran afinidad por el agua y los solventes polares. Sin embargo, cuando el número de átomos de carbono es mayor a cuatro, predomina el carácter hidrofóbico de las cadenas R y se hacen inmiscibles con el agua.
En fase sólida o líquida juegan un papel importante la longitud de la cadena R y los sustituyentes que esta posee. Así, cuando las cadenas son muy largas, estas interaccionan entre sí mediante las fuerzas de dispersión de London, como en el caso de los ácidos grasos.
Acidez
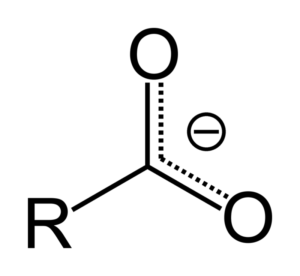
Cuando el ácido carboxílico dona un protón, se convierte en el anión carboxilato, representado en la imagen superior. En este anión la carga negativa se deslocaliza entre los dos átomos de carbono, estabilizándolo y, por consiguiente, favoreciendo a que la reacción ocurra.
¿Cómo varía esta acidez de un ácido carboxílico a otro? Todo depende de la acidez del protón en el grupo OH: mientras más pobre sea en electrones, más ácido es.
Esta acidez puede aumentarse si uno de los sustituyentes de la cadena R es una especie electronegativa (que atrae o retira densidad electrónica de sus alrededores).
Por ejemplo, si en el CH3–COOH se sustituye un H del grupo metilo por un átomo de flúor (CFH2–COOH) la acidez aumenta considerablemente porque el F retira densidad electrónica del carbonilo, del oxígeno, y luego del hidrógeno. Si se sustituyen todos los H por F (CF3–COOH) la acidez llega a su valor máximo.
¿Qué variable determina el grado de acidez? El pKa. Mientras menor sea el pKa y más cercano a 1, mayor es la capacidad del ácido de disociarse en agua y, a su vez, más peligroso y nocivo. Del ejemplo anterior, CF3–COOH tiene el menor valor de pKa.
Usos/aplicaciones de los ácidos carboxílicos
Debido a la inmensa variedad de ácidos carboxílicos, cada uno de estos tiene destinada una aplicación potencial en la industria, sea esta de polímeros, farmacéutica o alimenticia.
Industria alimentaria
- Aditivos.
- Conservantes (ácido sórbico y ácido benzoico).
- Regulador de la alcalinidad de muchos productos.
- Producción de refrescos.
- Agentes antimicrobianos ante la acción de los antioxidantes. En este caso, la tendencia son los antimicrobianos líquidos que posibiliten la biodisponibiidad.
- Principal ingrediente del vinagre común (ácido acético).
- Acidulante en bebidas carbonatadas y alimentos (ácido cítrico y ácido láctico).
- Ayudante en la maduración del queso suizo (ácido propiónico).
- Elaboración de queso, chucrut, col fermentada y bebidas suaves (ácido láctico).
Industria farmacéutica
- Antipirético y analgésico (ácido acetilsalicílico).
- Activo en el proceso de síntesis de aromas, en algunos fármacos (ácido butírico o butanoico).
- Antimicótico (ácido benzoico combinado con ácido salicílico).
- Activo para fabricación de medicamentos a base de vitamina C (Ácido ascórbico).
- Fungicida (ácido caprílico).
- Fabricación de algunos laxantes (ácido hidroxibutanodioico).
Otras industrias
- Fabricación de plásticos y lubricantes (ácido sórbico).
- Fabricación de barnices, resinas elásticas y adhesivos transparentes (ácido acrílico).
- Fabricación de pinturas y barnices (ácido linoleico).
- Fabricación de jabones, detergentes, champús, cosméticos y productos de limpieza de metales (ácido oleico).
- Fabricación de pasta dental (ácido salicílico).
- Producción de acetato de rayón, películas fotográficas y disolventes para pinturas (ácido acético).
- Producción de tintes y curtidos (ácido metanoico).
- Elaboración de aceites lubricantes, materiales impermeables y secante de pinturas (ácido palmítico).
- Fabricación de caucho (ácido acético).
- Elaboración de goma y en la galvanoplastia.
- Disolvente.
- Producción de perfumes (ácido benzoico).
- Fabricación de plastificantes y resinas (ácido ftálico).
- Elaboración del poliéster (ácido tereftálico).
- Elaboración de velas de parafina (ácido esteárico).
Referencias
- Graham Solomons T.W., Craig B. Fryhle. Organic Chemistry. Carboxylic Acids and Their Derivatives (10th edition., pag 779-783). Wiley Plus.
- Organic Acids. Recuperado de naturalwellbeing.com
- Francis A. Carey. Química Orgánica. Ácidos carboxílicos. (sexta edición., pág 805-820). Mc Graw Hill.
- William Reusch. Carboxylic Acids. Recuperado de chemistry.msu.edu
