Valina: características, funciones, alimentos ricos, beneficios
La valina pertenece a los 22 aminoácidos identificados como los componentes “básicos” de las proteínas; se identifica con el acrónimo “Val” y con la letra “V”. Este aminoácido no puede ser sintetizado por el cuerpo humano, por tanto, es catalogado en el grupo de los nueve aminoácidos esenciales para los humanos.
Muchas proteínas globulares poseen un interior rico en residuos de valina y leucina, ya que ambos se asocian mediante interacciones hidrofóbicas y son indispensables para el plegamiento de la estructura y la conformación tridimensional de las proteínas.
La valina fue purificada por primera vez en el año 1856 por V. Grup-Besanez a partir de un extracto acuoso del páncreas. Sin embargo, el nombre “valina” fue acuñado por E. Fisher en el año 1906, cuando logró sintetizarlo artificialmente y observó que su estructura era muy similar a la del ácido valérico, encontrado en las plantas conocidas comúnmente como “valerianas”.
La valina es uno de los aminoácidos que se encuentran en posiciones conservadas en ciertas proteínas compartidas por los vertebrados, por ejemplo, en la posición 80 del citocromo C de los vertebrados se encuentran leucina, valina, isoleucina y metionina en el mismo orden.
En los tejidos o biomateriales con características resistentes, duras y elásticas como los ligamentos, tendones, vasos sanguíneos, hilos o telarañas, se encuentran grandes cantidades de valina, que le proporciona flexibilidad y resistencia gracias a sus interacciones hidrofóbicas con otros aminoácidos.
Una sustitución de un residuo de glutamato por uno de valina en la cadena β de la hemoglobina, la proteína encargada del transporte de oxígeno por la sangre causa una mal formación en la estructura proteica, lo que origina la hemoglobina “S”.
Esta mutación produce la anemia falciforme o drepanocitosis, una condición patológica en la que los glóbulos rojos adquieren una forma de media luna o de hoz característica, que los diferencia de los glóbulos normales, de aspecto redondeado y aplanado.
Algunos de los herbicidas más empleados en la actualidad poseen como compuestos activos a la sulfonilurea y al metil sulfometuron, que causan daños a la enzima acetolactato sintasa, necesaria para el primer paso de síntesis de la valina, la leucina y la isoleucina. El daño causado por estos pesticidas evita que las hierbas y malezas puedan desarrollarse normalmente.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en valina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
La valina es un aminoácido con un esqueleto de cinco carbonos y pertenece al grupo de los aminoácidos con cadenas laterales alifáticas. Su carácter hidrofóbico es tal, que puede compararse con el de la fenilalanina, el de la leucina y el de la isoleucina.
Los aminoácidos que poseen cadenas hidrocarbonadas en sus grupos R o cadenas laterales, se conocen comúnmente en la bibliografía como aminoácidos ramificados o de cadena ramificada. En este grupo se encuentran la valina, la fenilalanina, la leucina y la isoleucina.
Generalmente, los aminoácidos de este grupo son empleados como elementos estructurales internos en la síntesis de proteínas, pues estos pueden asociarse entre sí por medio de interacciones hidrofóbicas, “huyendo” del agua y estableciendo los plegamientos estructurales característicos de muchas proteínas.
Su peso molecular está alrededor de los 117 g/mol y, puesto que su grupo R o cadena lateral es un hidrocarburo ramificado, no tiene carga y su abundancia relativa en las estructuras proteicas es poco mayor del 6%.
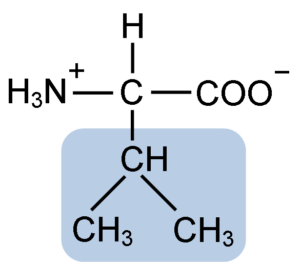
La valina comparte la estructura general y los tres grupos químicos típicos de todos los aminoácidos: el grupo carboxilo (COOH), el grupo amino (NH2) y un átomo de hidrógeno (-H). En su grupo R o cadena lateral posee tres átomos de carbono que le otorgan características muy hidrofóbicas.
Como es cierto para todos los compuestos químicos clasificados como “aminoácidos”, la valina posee un átomo de carbono central que es quiral y que se conoce como carbono α, al cual se unen los cuatro grupos químicos mencionados.
El nombre IUPAC de la valina es ácido 2-3-amino-3-butanóico, pero algunos químicos también la denominan ácido α-amino valeriano y su fórmula química es C5H11NO2.
Todos los aminoácidos pueden encontrarse en la forma D o L y la valina no es la excepción. Sin embargo, la forma L-valina es mucho más abundante que la forma D-valina y, además, es espectroscópicamente más activa que la forma D.
La L-valina es la forma que se emplea para la formación de las proteínas celulares y por lo tanto es, de las dos, la forma biológicamente activa. Cumple funciones como nutracéutico, micronutriente para las plantas, metabolito para humanos, algas, levaduras y bacterias, entre muchas otras funciones.
La valina, a pesar de ser uno de los nueve aminoácidos esenciales, no desempeña un papel significativo adicional a su participación en la síntesis de proteínas y como metabolito en su propia ruta de degradación.
No obstante, los aminoácidos voluminosos como la valina y la tirosina son los responsables de la flexibilidad de la fibroína, el principal componente proteico de los hilos de seda que producen los gusanos de la especie Bombyx mori, comúnmente conocidos como gusanos de la seda o del árbol de morera.
Tejidos como los ligamentos y vasos sanguíneos arteriales están compuestos por una proteína fibrosa conocida como elastina. Esta se compone de cadenas polipeptídicas con secuencias repetidas de los aminoácidos glicina, alanina y valina, siendo la valina el residuo más importante respecto a la extensión y flexibilidad de la proteína.
La valina participa en las principales rutas de síntesis de los compuestos responsables del olor característico de las frutas. Las moléculas de valina son transformadas en derivados metilados y ramificados de ésteres y alcoholes.
Existen muchos aditivos químicos que emplean valina en combinación con glucosa para obtener olores apetecibles en ciertas preparaciones culinarias.
A una temperatura de 100 °C, estos aditivos tienen un olor característico a centeno y a más de 170 °C huelen a chocolate caliente, por lo que son populares en la producción de alimentos en la industria panadera y pastelera (repostería).
Dichos aditivos químicos emplean L-valina sintetizada artificialmente, puesto que su purificación a partir de fuentes biológicas es engorrosa y no suele obtenerse el grado de pureza requerido.
Todos los aminoácidos de cadena ramificada como son la valina, la leucina y la isoleucina son sintetizados principalmente en plantas y bacterias. Lo que quiere decir que los animales como el ser humano y otros mamíferos necesitan ingerir alimentos ricos en estos aminoácidos para poder suplir sus requerimientos nutricionales.
Usualmente, la biosíntesis de la valina comienza con la transferencia de dos átomos de carbono desde el pirofosfato de hidroxietil-tiamina al piruvato por acción de la enzima ácido acetohidroxi-isómero reductasa.
Los dos átomos de carbono derivan de una segunda molécula de piruvato a través de una reacción dependiente de TPP muy parecida a la que cataliza la enzima piruvato descarboxilasa, pero que es catalizada por la dihidroxi-ácido deshidratasa.
La enzima valina aminotransferasa, finalmente, incorpora un grupo amino al compuesto cetoácido resultante de la descarboxilación anterior, con lo que se forma la L-valina. Los aminoácidos leucina, isoleucina y valina tienen una gran semejanza estructural, y ello se debe a que comparten muchos intermediarios y enzimas en sus rutas biosintéticas.
El cetoácido producido durante la biosíntesis de la L-valina regula algunos pasos enzimáticos por retroalimentación negativa o regulación alostérica en la ruta biosintética de la leucina y de los demás aminoácidos relacionados.
Esto quiere decir que las rutas biosintéticas son inhibidas por un metabolito generado en las mismas que, cuando se acumula, le da a las células una señal específica que les indica que un determinado aminoácido está en exceso y por tanto su síntesis puede detenerse.
Los primeros tres pasos de degradación de la valina son compartidos en la ruta de degradación de todos los aminoácidos de cadena ramificada.
La valina puede entrar en el ciclo del ácido cítrico o ciclo de Krebs a ser transformada en succinil-CoA. La ruta de degradación consiste en una transaminación inicial, catalizada por una enzima conocida como aminotransferasa de aminoácidos de cadena ramificada (BCAT).
Esta enzima cataliza una transaminación reversible que consigue convertir los aminoácidos de cadena ramificada en sus α-cetoácidos de cadena ramificada correspondientes.
En esta reacción es imprescindible la participación del par glutamato/2-cetoglutarato, pues el 2-cetoglutarato recibe el grupo amino que se remueve del aminoácido que está siendo metabolizado y se convierte en glutamato.
Este primer paso de reacción del catabolismo de la valina produce el 2-cetoisovalerato y es acompañada de la conversión de piridoxal 5’-fosfato (PLP) en piridoxamina 5’-fosfato (PMP).
Seguidamente, el 2-cetoisovalerato es empleado como sustrato de un complejo enzimático mitocondrial, conocido como deshidrogenasa de α-cetoácidos de cadena ramificada, que agrega una porción CoASH y forma el isobutiril-CoA, que subsecuentemente es deshidrogenado y convertido en metacrilil-CoA.
El metacrilil-CoA es procesado aguas abajo en 5 pasos enzimáticos adicionales que implican hidratación, eliminación de la porción CoASH, oxidación, adición de otra porción CoASH y reordenamiento molecular, que terminan con la producción de succinil-CoA, que ingresa de inmediato al ciclo de Krebs.
Las proteínas contenidas en las semillas de sésamo o de ajonjolí son ricas en valina, con casi 60 mg del aminoácido por cada gramo de proteína. Por esta razón, las galletas, bizcochos y barras o turrones de sésamo son recomendadas para niños con dietas deficientes de este aminoácido.
Los granos de soya, en general, son ricos en todos los aminoácidos esenciales, incluso en valina. Sin embargo, son pobres en metionina y cisteína. La proteína o el texturizado de soya posee estructuras cuaternarias muy complejas, pero que son fáciles de disolver y separar en subunidades más pequeñas en presencia de los jugos gástricos.
La caseína, que se encuentra típicamente en la leche y sus derivados, es rica en secuencias repetidas de valina. Al igual que la proteína de la soya, esta proteína es fácilmente degradada y absorbida en el tracto intestinal de los mamíferos.
Se ha estimado que por cada 100 gramos de proteína de soya se ingieren cerca de 4,9 gramos de valina; mientras que por cada 100 ml de leche se ingieren cerca 4,6 ml de valina.
Otros alimentos ricos en dicho aminoácido son la carne de res, de pescado y diversos tipos de vegetales y verduras.
La valina, como gran parte de los aminoácidos, es un aminoácido glucogénico, es decir, puede incorporarse en la ruta gluconeogénica, y muchos neurólogos afirman que su ingesta ayuda a mantener la salud mental, la coordinación muscular y a disminuir el estrés.
Muchos atletas consumen comprimidos ricos en valina, ya que ayudan a la regeneración de los tejidos, especialmente los tejidos musculares. Al ser un aminoácido capaz de incorporarse en la gluconeogénesis ayuda a la producción de energía, lo que no sólo es importante para la actividad física sino para el funcionamiento nervioso.
Los alimentos ricos en valina ayudan a mantener el equilibrio de los compuestos nitrogenados en el cuerpo. Este equilibrio es esencial para la generación de energía a partir de las proteínas ingeridas, para el crecimiento del cuerpo y la cicatrización.
Su consumo previene daños en el hígado y la vesícula biliar, así como contribuye a la optimización de muchas funciones corporales.
Uno de los suplementos dietéticos más populares entre los atletas para aumentar el volumen muscular y la recuperación muscular es el BCAA.
Este tipo de comprimidos consiste en tabletas con mezclas de diferentes aminoácidos entre los que se incluyen, generalmente, aminoácidos de cadena ramificada como la L-valina, la L-isoleucina y la L-leucina; también son ricos en vitamina B12 y en otras vitaminas.
Algunos experimentos realizados con cerdos han demostrado que los requerimientos de valina son mucho más altos y limitantes para las madres durante la etapa de lactancia, ya que este aminoácido ayuda a la secreción de la leche y produce mejoras en la tasa de crecimiento de neonatos lactantes.
La ingesta de valina diaria recomendada para infantes ronda los 35 mg por cada gramo de proteína consumida, mientras que para adultos la cantidad es un poco menor (alrededor de 13 mg).
La enfermedad más común relacionada con la valina y con otros aminoácidos de cadena ramificada se conoce como “enfermedad de la orina con olor a jarabe de arce” o “Cetoaciduria”.
Esta es una condición hereditaria causada por un defecto en los genes que codifican para las enzimas deshidrogenasas de los α-cetoácidos derivados de la leucina, la isoleucina y la valina, que son necesarias para metabolizarlos.
En esta enfermedad el organismo no puede asimilar ninguno de estos tres aminoácidos cuando son obtenidos de la dieta, por ende, los cetoácidos derivados se acumulan y son expulsados en la orina (también pueden detectarse en el suero sanguíneo y en el líquido cefalorraquídeo).
Por otra parte, una dieta deficiente en valina ha sido relacionada con patologías neurológicas como la epilepsia. También puede ocasionar pérdida de peso, enfermedad de Huntington e incluso puede terminar en el desarrollo de ciertos tipos de cáncer, puesto que el sistema de reparación de tejidos y la síntesis de biomoléculas se ve comprometido.
- Abu-Baker, S. (2015). Review of Biochemistry: Concepts and Connections
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
- Plimmer, R. H. A., & Phillips, H. (1924). The Analysis of Proteins. III. Estimation of Histidine and Tyrosine by Bromination. Biochemical Journal, 18(2), 312
- Plimmer, R. H. A. (1912). The chemical constitution of the proteins (Vol. 1). Longmans, Green.
- Torii, K. A. Z. U. O., & Iitaka, Y. (1970). The crystal structure of L-valine. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry, 26(9), 1317-1326.
- Tosti, V., Bertozzi, B., & Fontana, L. (2017). Health benefits of the mediterranean diet: metabolic and molecular mechanisms. The Journals of Gerontology: Series A, 73(3), 318-326.
