Etano: qué es, estructura química, propiedades, usos, riesgos
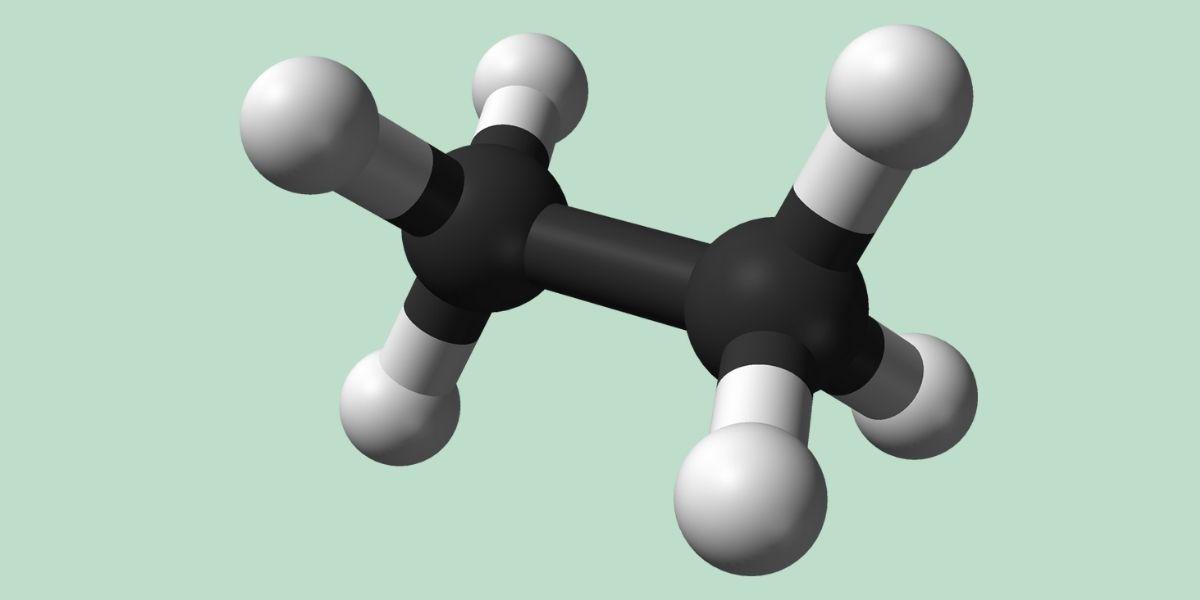
¿Qué es el etano?
El etano es un hidrocarburo sencillo de fórmula C2H6 con una naturaleza de gas incoloro e inodoro que tiene un uso altamente valioso y diversificado en la síntesis de etileno. Además, es uno de los gases terrestres que también ha sido detectado en otros planetas y cuerpos estelares alrededor del Sistema Solar. Fue descubierto por el científico Michael Faraday en 1834.
Entre la gran cantidad de compuestos orgánicos formados por átomos de carbono e hidrógeno (conocidos como hidrocarburos), existen aquellos que se encuentran en un estado gaseoso a temperaturas y presiones ambientales, los cuales son utilizados enormemente en numerosas industrias.
Estos suelen provenir de la mezcla gaseosa llamada “gas natural”, un producto de alto valor para la humanidad, y componen los alcanos de tipo metano, etano, propano y butano, entre otros; clasificándose según la cantidad de átomos de carbono en su cadena.
Estructura química del etano
El etano es una molécula con fórmula C2H6, típicamente vista como una unión de dos grupos metilo (-CH3) para formar el hidrocarburo de un enlace simple carbono-carbono. Es, además, el compuesto orgánico más sencillo después del metano, representándose así:
H3C-CH3
Los átomos de carbono en esta molécula poseen hibridación del tipo sp3, por lo que los enlaces moleculares presentan rotación libre.
Asimismo, existe un fenómeno intrínseco del etano, el cual se basa en la rotación de la estructura molecular del mismo y la energía mínima requerida para producir una rotación de enlace de 360 grados, la cual los científicos han llamado “barrera de etano”.
Por esta razón, el etano puede presentarse en distintas configuraciones según su rotación, aun cuando su conformación más estable existe donde los hidrógenos están opuestos unos a otros (como se observa en la figura).
Síntesis del etano
El etano puede ser sintetizado fácilmente a partir de la electrólisis de Kolbe, una reacción orgánica en la que ocurren dos pasos: una descarboxilación electroquímica (remoción del grupo carboxilo y liberación de dióxido de carbono) de dos ácidos carboxílicos, y la combinación de los productos intermedios para formar un enlace covalente.
De manera similar, la electrólisis del ácido acético da lugar a la formación de etano y dióxido de carbono, y esta reacción es utilizada para sintetizar el primero.
La oxidación de anhídrido acético por la acción de peróxidos, un concepto parecido al de la electrólisis de Kolbe, también da como resultado la formación de etano.
Del mismo modo, puede ser separado de manera eficiente del gas natural y del metano por un proceso de licuefacción, haciendo uso de sistemas criogénicos para captar este gas y separarlo de mezclas con otros gases.
El proceso de la turboexpansión es el preferido para este rol: se hace pasar la mezcla de gases por una turbina, generando una expansión de la misma, hasta que su temperatura cae por debajo de los -100° C.
Ya en este punto, se pueden diferenciar los componentes de la mezcla, por lo que se separará el etano líquido del metano gaseoso y las otras especies involucradas con el uso de una destilación.
Propiedades del etano
El etano se presenta en la naturaleza como un gas inodoro e incoloro a presiones y temperaturas estándares (1 atm y 25° C). Posee un punto de ebullición de -88,5° C, y un punto de fusión de -182,8° C. Además, no se ve afectado por exposición a ácidos o bases fuertes.
Solubilidad del etano
Las moléculas de etano son de configuración simétrica y poseen fuerzas débiles de atracción que las mantienen juntas, llamadas fuerzas de dispersión.
Cuando el etano se intenta disolver en agua, las fuerzas de atracción formadas entre el gas y el líquido son muy débiles, por lo que muy difícilmente se unirá el etano con las moléculas de agua.
Por esta razón, la solubilidad del etano es considerablemente baja, aumentando ligeramente cuando se eleva la presión del sistema.
Cristalización del etano
El etano puede ser solidificado, logrando que se formen cristales de etano inestables con estructura cristalina cúbica.
Con una disminución de temperatura más allá de los -183,2° C, esta estructura pasa a ser monoclínica, aumentando la estabilidad de su molécula.
Combustión del etano
Este hidrocarburo, aun cuando no es ampliamente usado como combustible, puede ser utilizado en procesos de combustión para generar dióxido de carbono, agua y calor, lo cual se representa así:
2C2H6 + 7O2 → 4CO2 + 6H2O + 3120 kJ
También existe la posibilidad de quemar esta molécula sin un exceso de oxígeno, lo cual se conoce como “combustión incompleta”, y que da como resultado la formación de carbón amorfo y monóxido de carbono en una reacción no deseada, según la cantidad de oxígeno aplicada:
2C2H6 + 3O2 → 4C + 6H2O + Calor
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Calor
2C2H6 + 5O2 → 4CO + 6H2O + Calor
En este ámbito, la combustión ocurre por una serie de reacciones de radicales libres, las cuales se numeran en los cientos de reacciones distintas. Por ejemplo, en las reacciones de combustión incompleta pueden formarse compuestos como el formaldehído, acetaldehído, metano, metanol y etanol.
Esto dependerá de las condiciones en las que ocurre la reacción y las reacciones de radicales libres involucradas. También puede formarse el etileno a temperaturas altas (600-900° C), el cual es un producto altamente deseado por la industria.
Etano en la atmósfera y en cuerpos celestes
El etano está presente en la atmósfera del planeta Tierra en trazas, y se sospecha que el ser humano ha logrado duplicar esta concentración desde que comenzó a practicar actividades industriales.
Los científicos piensan que gran parte de la presencia actual de etano en la atmósfera se debe a la combustión de combustibles fósiles, aunque la emisión mundial de etano ha disminuido casi a la mitad desde que se mejoraron las tecnologías de producción de gas de lutita (una fuente de gas natural).
Esta especie también se produce naturalmente por efecto de los rayos solares sobre el metano atmosférico, el cual se recombina y forma una molécula de etano.
Existe etano en estado líquido sobre la superficie de Titán, una de las lunas de Saturno. Esta se presenta en mayor cantidad en el río Vid Flumina, el cual fluye por más de 400 kilómetros hacia uno de sus mares. También se ha evidenciado este compuesto sobre cometas, y en la superficie de Plutón.
Usos del etano
Producción de etileno
La utilización del etano se basa principalmente en la producción de etileno, el producto orgánico de mayor uso en la producción mundial, a través de un proceso conocido como craqueo en fase de vapor.
Este proceso consiste en hacer pasar una alimentación de etano diluido con vapor a un horno, calentándolo rápidamente sin oxígeno.
La reacción ocurre a una temperatura sumamente alta (entre 850 y 900° C), pero el tiempo de residencia (el tiempo que pasa el etano dentro del horno) debe ser breve para que la reacción sea efectiva. A mayores temperaturas, se genera mayor cantidad de etileno.
Formación de químicos básicos
El etano también ha sido estudiado como componente principal en la formación de químicos básicos. La cloración oxidativa es uno de los procesos planteados para la obtención de cloruro de vinilo (un componente del PVC), reemplazando otros menos económicos y más complicados.
Refrigerante
Finalmente, el etano es usado como refrigerante en sistemas criogénicos comunes, también mostrando capacidades de congelar muestras pequeñas en el laboratorio para su análisis.
Es un muy buen sustituto para el agua, el cual tarda más en enfriar las delicadas muestras, y además puede generar la formación de cristales de hielo dañinos.
Riesgos del etano
-El etano tiene la capacidad de inflamarse, principalmente cuando se une con el aire. A porcentajes de 3,0 a 12,5% de volumen de etano en el aire, puede formarse una mezcla explosiva.
-Puede limitar el oxígeno en el aire en que se encuentre, y por esta razón presenta un factor de riesgo de asfixia para las personas y animales que se encuentren presentes y expuestos.
-El etano en forma líquida congelada puede quemar gravemente la piel si entra en contacto directo con ella, y también actuar como medio criogénico para cualquier objeto que toque, congelándolo en instantes.
-Los vapores del etano líquido son más pesados que el aire y se concentran sobre el suelo, esto puede presentar un riesgo de ignición que puede generar una reacción de combustión en cadena.
-La ingestión de etano puede provocar náuseas, vómitos y hemorragias internas. La inhalación, además de asfixia, causa dolores de cabeza, confusión y cambio de humor. La muerte por paro cardíaco es posible a altas exposiciones.
-Representa un gas de efecto invernadero que, junto con el metano y el dióxido de carbono, contribuye al calentamiento global y al cambio climático generado por la contaminación humana. Por suerte, es menos abundante y duradero que el metano, y absorbe menos radiación que este.
Referencias
- Britannica, E. (s.f.). Ethane. Obtenido de britannica.com
- Nes, G. V. (s.f.). Single-crystal structures and electron density distributions of ethane, ethylene and acetylene. Recuperado de rug.nl
- Sites, G. (s.f.). Ethane: Sources and Sinks. Obtenido de sites.google.com
- SoftSchools (s.f.). Ethane Formula. Recuperado de softschools.com
- Wikipedia (s.f.). Ethane. Obtenido de en.wikipedia.org
