Oxalato de calcio (CaC2O4): propiedades, estructura, usos, riesgos
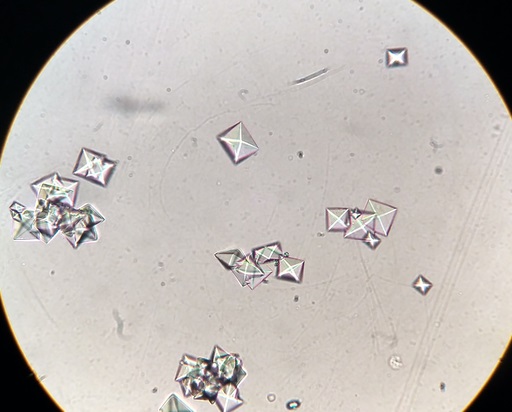
El oxalato de calcio es un compuesto orgánico formado por los elementos carbono (C), oxígeno (O) y calcio (Ca). Su fórmula química es CaC2O4. Se encuentra generalmente en sus tres formas hidratadas: mono-, di- y trihidrato. Esto es, con una, dos o tres moléculas de agua respectivamente en su estructura cristalina.
El oxalato de calcio se encuentra en minerales, plantas, hongos y otros seres vivos como mamíferos e incluso en los seres humanos como consecuencia del metabolismo de algunas proteínas. Se puede hallar en la orina de humanos y de algunos animales.
Algunos alimentos como las espinacas, los ruibarbos, la soya y el chocolate contienen muchos oxalatos y cuando las personas sensibles los ingieren se pueden formar piedras de oxalato de calcio en sus riñones.
Se puede evitar la aparición de piedras de CaC2O4 en los riñones si se ingieren muchos líquidos, especialmente agua, evitando alimentos con alto contenido de oxalatos y consumiendo aquellos ricos en calcio y magnesio.
El oxalato de calcio forma incrustaciones indeseables en tuberías y tanques de procesos como los de fabricación de pulpa y papel, y también en las fábricas de cerveza.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Presencia en la naturaleza
- 5 Presencia en el cuerpo humano y en mamíferos
- 6 Usos
- 7 Riesgos
- 8 Referencias
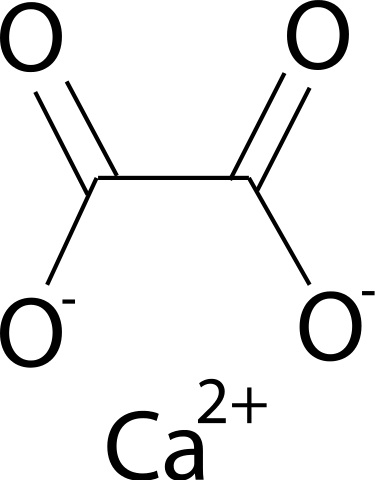
El oxalato de calcio está formado por el ion calcio Ca2+ y el ion oxalato C2O42-. El anión oxalato está formado por dos átomos de carbono y cuatro átomos de oxígeno. Las cargas negativas del anión oxalato se encuentran en los átomos de oxígeno.
- Oxalato de calcio
- Sal de calcio del ácido oxálico
- Sal de calcio del ácido etanodioico
Sólido cristalino incoloro, blanco, amarillo o marrón que puede estar en tres formas hidratadas diferentes.
128,1 g/mol
El monohidrato del oxalato de calcio se descompone a 200 °C.
Monohidrato CaC2O4•H2O = 2,22 g/cm3
Dihidrato CaC2O4•2H2O = 1,94 g/cm3
Trihidrato CaC2O4•3H2O = 1,87 g/cm3
Casi insoluble en agua: 0,00061 g/100 g de agua a 20 °C. El monohidrato se disuelve en ácido diluido.
Las soluciones acuosas de oxalato de calcio son débilmente básicas.
El oxalato de calcio es la sal cálcica del ácido oxálico. Este es un producto secundario natural del metabolismo, por lo que es muy abundante en el cuerpo humano, y forma parte de muchos alimentos.
El ácido oxálico y su base conjugada, el oxalato, son compuestos orgánicos muy oxidados, con una poderosa actividad quelante, es decir, que pueden combinarse fácilmente con iones positivos con cargas de +2 o +3.
Sus soluciones acuosas son débilmente básicas debido a que el ion oxalato tiende a tomar protones H+ del agua, lo cual libera iones OH–. Tras tomar dos protones H+ el ion oxalato se convierte en ácido oxálico H2C2O4:
C2O42- + H2O → HC2O4– + OH–
HC2O4– + H2O → H2C2O4 + OH–
El oxalato de calcio es el oxalato más común y se presenta en forma de los minerales llamados whewellita, weddellita y caoxita.
La whewellita es el monohidrato CaC2O4•H2O y es el más estable de las formas de este compuesto.

La weddellita es el dihidrato CaC2O4•2H2O y es menos estable que el monohidrato.

La caoxita es el oxalato de calcio trihidratado CaC2O4•3H2O.
El oxalato de calcio se encuentra asociado con suelos y hojas secas, también con hongos patógenos, libres, en simbiosis o asociados con plantas. En estos últimos se forman cristales por la precipitación del calcio en forma de su oxalato.
La formación de CaC2O4 por los hongos tiene influencia importante en los procesos biológicos y geoquímicos de los suelos, pues constituye una reserva de calcio para el ecosistema.
El oxalato se origina en el hígado, en los glóbulos rojos o eritrocitos y en menor cantidad en el riñón. Se forma a partir del metabolismo de los aminoácidos (como la fenilalanina y el triptófano) y por oxidación del dialdehído glioxal,.
También la vitamina C puede convertirse en oxalato al realizar su función antioxidante.
El oxalato de calcio se encuentra en las piedras que se forman en los riñones de personas o animales con enfermedad renal.
Los llamados cálculos o piedras de oxalato de calcio se forman por la cristalización o agregación del CaC2O4 en orina sobresaturada con calcio y oxalato. Esto significa que la orina contiene tanto calcio y oxalato que no es posible que dicho compuesto permanezca disuelto, sino que precipita o pasa al estado sólido en forma de cristales.
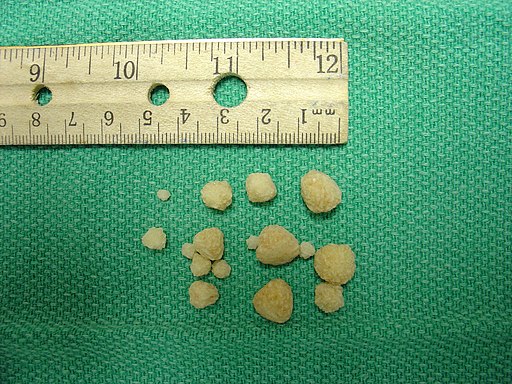
La formación de arenilla o piedras en los riñones es una enfermedad que se denomina nefrolitiasis; ataca aproximadamente el 10% de la población y cerca del 75% de dichas piedras está compuesto de oxalato de calcio CaC2O4.
La formación y crecimiento de los cristales de oxalato de calcio en el riñón ocurren debido a que en algunas personas la orina está sobresaturada de dicha sal. El oxalato de calcio se desarrolla en orina ácida en pH menor que 6,0.
La sobresaturación se presenta cuando la excreción o eliminación de esta sal (que es muy poco soluble en agua) por la orina ocurre en un pequeño volumen de agua.
Entre los factores que favorecen la formación de arenilla de oxalato de calcio se encuentran el exceso de calcio en la orina o hipercalciuria, el exceso de oxalato en la orina o hiperoxaluria, elementos derivados de la alimentación y la ausencia de inhibidores.
El exceso de oxalato puede presentarse cuando se ingieren altas cantidades de espinacas, ruibarbo, soya, nueces y chocolate, entre otros alimentos.

Sin embargo, hay sustancias que inhiben o evitan que ocurra la formación de piedras. Entre los compuestos que evitan la formación de cálculos están pequeñas moléculas como el citrato y el pirofosfato, y grandes moléculas como las glicoproteínas y los proteoglicanos.
Una buena estrategia para prevenir la recurrencia de arenilla o cálculos de oxalato de calcio incluye el aumento en la ingestión de líquidos, aumento en la ingestión de alimentos ricos en calcio (como los lácteos) y restringir la sal de mesa (NaCl), proteína animal y comidas ricas en oxalato.
Desde principios del año 2000 se ha observado aumento de las piedras de oxalato de calcio en el sistema urinario de gatos y perros. Parece ser que esto depende del tipo de alimentación que ingieren estos animales y tiene que ver con la acidez de la orina y la deficiencia de magnesio (Mg).
Existe evidencia de que tanto los humanos como los animales responden al exceso de oxalato mediante el aumento en el número de bacterias que pueden degradar el oxalato.
Algunas de estas bacterias son Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis y Bacillus sp., entre otras, y están presentes de forma natural en el intestino.
Según fuentes consultadas el oxalato de calcio se emplea en el recubrimiento de cerámicas.
Se ha utilizado para recubrir esculturas y otros elementos artísticos de piedra caliza, y se ha encontrado que mejora la dureza del material, disminuye su porosidad y aumenta su resistencia a ácidos y álcalis.

En la industria de pulpa y papel el oxalato de calcio puede formar incrustaciones que causan muchos problemas en el proceso.
Para evitar su formación en los conductos o tuberías de procesos industriales se ha propuesto la degradación enzimática del ácido oxálico, mediante enzimas como la oxalato oxidasa.
También tiende a acumularse como piedra en los recipientes donde se fabrica cerveza, de donde debe ser eliminado para evitar la formación de microorganismos que pueden dar un sabor desagradable a la bebida.
En altas concentraciones el oxalato puede causar la muerte en animales y ocasionalmente en humanos debido principalmente a sus efectos corrosivos.
La acumulación de oxalato y su ácido conjugado, el ácido oxálico, puede causar desórdenes como mal funcionamiento del corazón, piedras de oxalato de calcio, falla renal e incluso muerte por toxicidad.
- Glasauer, S.M. et al. (2013). Metals and Metalloids, Transformation by Microorganisms. Oxalates. In Reference Module in Earth Systems and Environmental Sciences. Recuperado de sciencedirect.com.
- Baumann, J. M. and Casella, R. (2019). Prevention of Calcium Nephrolithiasis: The Influence of Diuresis on Calcium Oxalate Crystallization in Urine. Adv Prev Med, 2019; 2019: 3234867. Recuperado de ncbi.nlm.nih.gov.
- Breshears, M.A. and Confer, A.W. (2017). The Urinary System. Calcium Oxalate Calculi. In Pathologic Basis of Veterinary Disease (Sixth Edition). Recuperado de sciencedirect.com.
- Huang, Y. er al. (2019). Tge Handling of Oxalate in tge Body and tge Origin of Oxalate in Calcium Oxalate Stones. Urol Int, 2019 Dec 5: 1-10. Recuperado de ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. et al. (2002). Biotechnology in the Pulp and Paper Industry. In Progress in Biotechnology. Recuperado de sciencedirect.com.
- Pahira, J.J. and Pevzner, M. (2007). Nephrolithiasis. Calcium Stones. In Penn Clinical Manual of Urology. Recuperado de sciencedirect.com.
- Worcester, E. M. (1994). Urinary Calcium Oxalate Crystal Growth Inhibitors. J Am Soc Nephrol 1994 Nov; 5(5 Suppl 1): S46-53). Recuperado de jasn.asnjournals.org.
- Finkielstein, V.A. and Goldfarb, D.S. (2006). Strategies for preventing calcium oxalate stones. Recuperado de ncbi.nlm.nih.gov.
- U.S. National Library of Medicine. (2019). Calcium oxalate. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. et al. (2015). Oxalate-degrading microorganisms or oxalate-degrading enzymes: wich is the future therapy for enzymatic dissolution of calcium-oxalate uroliths in recurrent stone disease? Urolithiasis, 2016 Feb; 44(1): 27-32. Recuperado de ncbi.nlm.nih.gov.
- Holames, R.P. et al. (2016). Lowering urinary oxalate excretion to decrease calcium oxalate stone disease. Urolithiasis. 2016 February; 44(1); 27-32. Recuperado de ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Calcium Oxalate: A Surface Treatment for Limestone. Journal of Conservation and Museum Studies 4, pp.6-10. Recuperado de jcms-journal.com.
- Wikimedia (2019). Calcium Oxalate. Recuperado de en.wikipedia.org.
