Hidroxiapatita: estructura, síntesis, cristales, usos

¿Qué es la hidroxiapatita?
La hidroxiapatita es un mineral de fosfato de calcio, cuya fórmula química es Ca10(PO4)6(OH)2. Junto a otros minerales y restos de materia orgánica triturados y compactados, conforma la materia prima conocida como roca fosfórica. El término hidroxi se refiere al anión OH–.
Si en vez de ese anión fuera el fluoruro, el mineral se llamaría fluoroapatita (Ca10(PO4)6(F)2; y así con otros aniones (Cl–, Br–, CO32–, etc.). Asimismo, la hidroxiapatita es el principal componente inorgánico de los huesos y del esmalte dental, presente predominantemente en forma cristalina.
Entonces, es un elemento vital en los tejidos óseos de los seres vivos. Su gran estabilidad frente a otros fosfatos de calcio le permite soportar las condiciones fisiológicas, dándoles a los huesos su dureza característica. La hidroxiapatita no está sola: cumple su función acompañada del colágeno, proteína fibrosa de los tejidos conjuntivos.
La hidroxiapatita (o hidroxilapatita) contiene iones Ca2+, pero también puede albergar en su estructura otros cationes (Mg2+, Na+), impurezas que intervienen en otros procesos bioquímicos de los huesos (como su remodelación).
Estructura de la hidroxiapatita
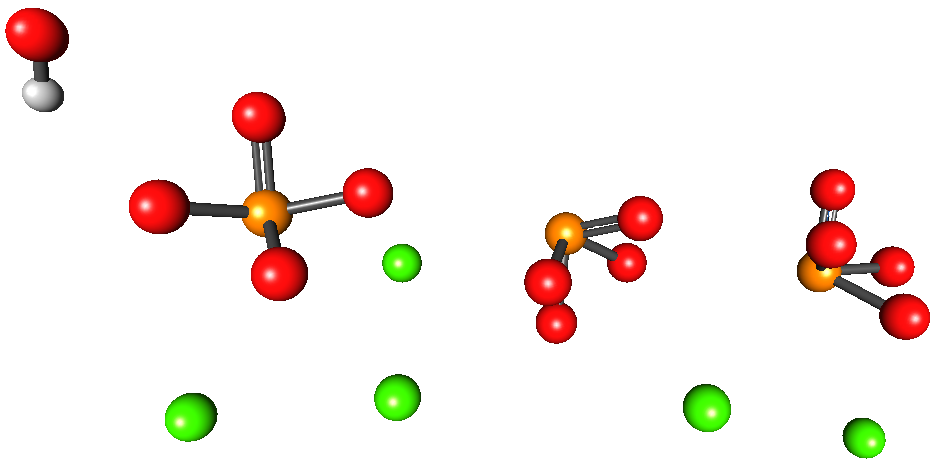
La imagen superior ilustra la estructura de la hidroxiapatita de calcio. Todas las esferas ocupan el volumen de la mitad de un “cajón” hexagonal, donde la otra mitad es idéntica a la primera.
En esta estructura las esferas verdes corresponden a los cationes Ca2+, mientras que las esferas rojas a los átomos de oxígeno, las anaranjadas a los átomos de fósforo, y la blanca al átomo de hidrógeno del OH–.
Los iones fosfatos en esta imagen tienen el defecto de no exhibir una geometría tetraédrica; en lugar de ello, parecen pirámides de bases cuadradas.
El OH– da la impresión de que está ubicado lejos de los Ca2+. Sin embargo, la unidad cristalina puede repetirse a sí misma en el techo de la primera, mostrando así la estrecha cercanía entre ambos iones. Asimismo, estos iones pueden ser reemplazados por otros (Na+ y F–, por ejemplo).
Síntesis de la hidroxilapatita
Se puede sintetizar la hidroxilapatita mediante la reacción del hidróxido de calcio con el ácido fosfórico:
10 Ca(OH)2 + 6 H3PO4 => Ca10(PO4)6(OH)2 + 18 H2O
La hidroxiapatita (Ca10(PO4)6(OH)2) está expresada por dos unidades de fórmula Ca5(PO4)3OH.
Asimismo, la hidroxiapatita puede ser sintetizada a través de la reacción siguiente:
10 Ca(NO3)2.4H2O + 6 NH4H2PO4 => Ca10(PO4)6(OH)2 + 20 NH4NO3 + 52 H2O
Controlar la velocidad de precipitación permite a esta reacción generar nanopartículas de hidroxiapatita.
Cristales de hidroxiapatita
Los iones se compactan y crecen hasta formar un biocristal rígido y resistente. Este es utilizado como biomaterial de la mineralización de los huesos.
Sin embargo, necesita del colágeno, soporte orgánico que funge como molde de su crecimiento. Estos cristales y sus complicados procesos de formación dependerán del hueso (o del diente).
Estos cristales crecen impregnados de materia orgánica, y la aplicación de técnicas de microscopía electrónica los detallan en los dientes como agregados con formas de varillas denominadas prismas.
Usos de la hidroxilapatita
Uso médico y odontológico
Debido a su similitud en tamaño, cristalografía y composición con el tejido humano duro, la nanohidroxiapatita es atractiva para su uso en prótesis. También, la nanohidroxiapatita es biocompatible, bioactiva y natural, además de no ser tóxica ni inflamatoria.
En consecuencia, la cerámica de nanohidroxiapatita tiene una variedad de aplicaciones, las cuales incluyen:
- En la cirugía del téjido óseo es utilizada en el relleno de cavidades en cirugías ortopédicas, traumatológicas, maxilofaciales y dentales.
- Se usa como recubrimiento de implantes ortopédicos y dentales. Es un agente desensibilizante utilizado posteriormente al blanqueamiento dental. También se recurre a él como agente remineralizante en las pastas dentales y en el tratamiento temprano de las caries.
- Los implantes de acero inoxidable y titanio son recubiertos a menudo con hidroxiapatita para reducir su velocidad de rechazo.
- Es una alternativa a los injertos alogénicos y xenogénicos de huesos. El tiempo de sanación es más corto en presencia de la hidroxiapatita que en su ausencia.
- La nanohidroxiapatita sintética mimetiza a la hidroxiapatita presente naturalmente en la dentina y la apatita esmáltica, por lo que es ventajoso su uso en la reparación del esmalte e incorporación en las pastas dentales, así como en los enjuagues bucales.
Otros usos de la hidroxiapatita
- La hidroxiapatita se usa en los filtros de aire de los vehículos automotores para aumentar la eficiencia de estos en la absorción y descomposición del monóxido de carbono (CO). Esto reduce la contaminación ambiental.
- Se ha sintetizado un complejo alginato-hidroxiapatita que las pruebas de campo han señalado que es capaz de absorber al flúor a través del mecanismo de intercambio iónico.
- La hidroxiapatita es utilizada como un medio cromatográfico para las proteínas. Esta presenta cargas positivas (Ca++) y negativas (PO4-3), por lo que puede interactuar con las proteínas cargadas eléctricamente y permitir su separación por intercambio iónico.
- La hidroxiapatita también se ha utilizado como soporte para la electrofóresis de los ácidos nucleicos. Se logra separar el DNA del RNA, así como el DNA de una hebra simple del DNA de dos hebras.
Propiedades físicas y químicas
La hidroxiapatita es un sólido blanco que puede adquirir tonalidades grisáceas, amarillas y verdosas. Como es un sólido cristalino, presenta puntos de fusión elevados, indicativos de las fuertes interacciones electrostáticas; para la hidroxiapatita, este es de 1100 ºC.
Es más denso que el agua, con una densidad de 3,05 – 3,15 g/cm3. Además, es prácticamente insoluble en agua (0,3 mg/mL), lo cual se debe a los iones fosfatos.
Sin embargo, en medios ácidos (como en HCl) es soluble. Esta solubilidad se debe a la formación del CaCl2, sal altamente soluble en agua. Asimismo, los fosfatos se protonan (HPO42– y H2PO4–) e interaccionan en mejor grado con el agua.
La solubilidad de la hidroxiapatita en ácidos tiene importancia en la fisiopatología de las caries. Las bacterias en la cavidad bucal secretan ácido láctico, producto de la fermentación de la glucosa, que disminuye el pH de la superficie dental a menos de 5, por lo que la hidroxiapatita comienza a disolverse.
El flúor (F–) puede sustituir a los iones OH– en la estructura cristalina. Cuando esto sucede aporta resistencia a la hidroxiapatita del esmalte dental frente a los ácidos.
Posiblemente, esta resistencia pueda deberse a la insolubilidad del CaF2 formado, negándose a “abandonar” el cristal.
Referencias
- Shiver & Atkins. (2008). Inorganic Chemistry. (Fourth ed., pág. 349, 627). Mc Graw Hill.
- Fluidinova. (2017). Hidroxylapatite. Recuperado de fluidinova.com
- Gaiabulbanix. (05 de noviembre de 2015). Hydroxyapatite. [Figura]. Recuperado de commons.wikimedia.org
- Martin.Neitsov. (25 de noviembre de 2015). Hüdroksüapatiidi kristallid. [Figura]. Recuperado de commons.wikimedia.org
- Wikipedia. (2018). Hydroxylapatite. Recuperado de en.wikipedia.org
- Fiona Petchey. Bone. Recuperado de c14dating.com
