Agar Hektoen: fundamento, preparación y usos
El agar Hektoen o agar Hektoen entérico es un medio de cultivo sólido, selectivo y diferencial. Fue creado en el Instituto Hektoen por King y Metzger para el aislamiento de bacterias enteropatógenas de los géneros Shigella y Salmonella.
El medio está compuesto por proteosa peptona, extracto de levadura, sales biliares, lactosa, sacarosa, salicina, tiosulfato de sodio, cloruro de sodio, citrato de hierro, citrato de amonio, azul de bromotimol, fucsina ácida y agar. Esta formulación permite diferenciar los géneros Shigella y Salmonella del resto de las bacterias capaces de crecer en este medio.
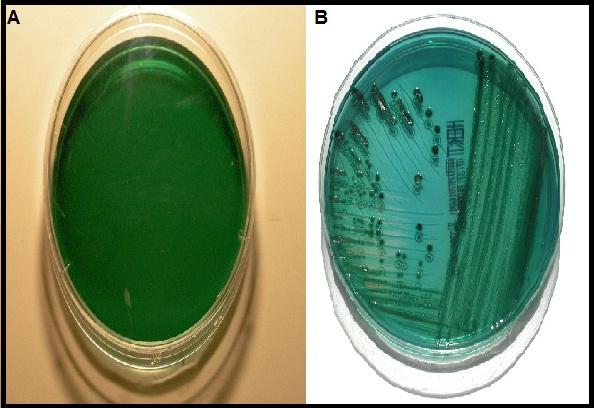
Aunque existen otros medios con la misma función que el agar Hektoen, este presenta mayor ventaja en comparación a otros medios, especialmente cuando se quieren recuperar especies de Shigella.
Las especies de ambos géneros producen problemas gastrointestinales severos en el ser humano por el consumo de alimentos contaminados; por tanto la transmisión es fecal – oral. Es por ello que el uso del agar Hektoen está principalmente indicado en el análisis microbiológico de muestras de heces y alimentos.
Índice del artículo
El agar Hektoen contiene peptonas y extracto de levadura como fuente de nutrientes, proporcionando los elementos esenciales para el desarrollo microbiano.
Sin embargo, también posee sales biliares que actúan inhibiendo el crecimiento de algunas bacterias, especialmente Gram positivas y algunas Gram negativas. Es por este motivo que se considera un medio selectivo.
Por otra parte, el agar Hektoen es un medio diferencial. Esta propiedad es conferida por la presencia de carbohidratos fermentables como la lactosa, la sacarora y la salicina, junto al sistema indicador de pH, representado por el azul de bromotimol y la fucsina ácida.
Todas las bacterias capaces de crecer en este medio que no pertenezcan al género Salmonella y Shigella desarrollarán colonias de color salmón o naranja a excepción del género Proteus. Esto se debe a la fermentación de uno o varios de los carbohidratos presentes, lo cual acidifica el medio, lo que hace virar al indicador de pH.
Por su parte, el género Shigella y Salmonella no son capaces de fermentar a ninguno de los carbohidratos presentes, utilizando únicamente a las peptonas como fuente de energía, lo que alcaliniza el medio y por ello sus colonias son verde-azuladas.
También en este medio se pueden distinguir las bacterias capaces de formar sulfuro de hidrógeno (gas incoloro). El tiosulfato de sodio actúa como fuente de sulfuro mientras que el citrato de hierro es el agente revelador. Ambos compuestos hacen posible la formación de un precipitado negro de sulfuro de hierro que evidencia la reacción.
El precipitado negro en el centro de la colonia con un halo transparente alrededor da un aspecto de ojo de pescado. Esta característica sugiere la presencia del género Salmonella.
Finalmente, el cloruro de sodio mantiene el equilibrio osmótico y el agar brinda la consistencia sólida al medio.
Pesar 76 gr del medio deshidratado y disolver en un litro de agua destilada. Agitar vigorosamente la mezcla y luego se deja en reposo por 10 a 15 minutos. Se puede calentar y hervir, dando movimientos rotatorios hasta su disolución total. Este medio no se esteriliza en autoclave.
Cuando el medio alcance una temperatura aproximada de 45°C se vierte de forma directa un volumen de 20 ml en placas de Petri estériles.
Se deja solidificar el agar. En ese momento ya están listas para su uso. Es recomendable utilizarlas de forma inmediata. De no ser posible se guardan en nevera hasta su uso.
Las placas deben sacarse anticipadamente de la nevera antes de sembrarlas para que tomen temperatura ambiente.
El pH del medio debe quedar en 7,5 ± 0,2. El color del medio deshidratado es color púrpura y preparado es verde amarronado.
Se recomienda el uso del agar Hektoen para la búsqueda de bacterias del género Shigella y Salmonella en muestras de heces y alimentos.
Se aumenta considerablemente la posibilidad de aislar a estas bacterias si previamente se enriquece la muestra en caldos especiales, tales como caldo selenito, caldo selenito cistina, caldo tetrationato, etc.
El inóculo debe ser fuerte y la siembra se realiza por estriamiento. Las placas se incuban a 37°C por 24 a 48 horas en aerobiosis.
Se recomienda la incubación por 48 horas debido a que las características de las colonias son más claras para su interpretación y diferenciación en este tiempo.
Para realizar el control de calidad a este medio se usan cepas bacterianas certificadas, tales como: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Shigella flexneri ATCC 12022 y Shigella sonnei ATCC 25931.
Los resultados esperados son los siguientes: Salmonella typhimurium y Salmonella enteritidis deben desarrollar colonias color verde – azuladas con o sin centro negro. En tanto que las especies de Shigella crecerán como colonias color verde – azuladas.
También se pueden incluir cepas de Escherichia coli ATCC 29212, Proteus mirabilis, Klebsiella pneumoniae ATCC 700603, Enterococcus faecalis ATCC 29212 y Staphylococcus aureus ATCC 25923.
En estos casos las características observadas son las siguientes: E. coli y K. pneumoniae desarrollarán en este medio colonias color salmón a naranja, con un precipitado del mismo color alrededor. En tanto que, Proteus desarrollará colonias azul-verdoso con o sin centro negro.
Mientras que S. aureus y E. faecalis deben ser inhibidos, en ocasiones E. faecalis logra crecer como colonias amarillas, muy pequeñas.
Por otra parte, debido a que este medio no se esteriliza en autoclave es importante evaluar la esterilidad del medio. Por ello, de cada lote preparado se deben incubar de una a dos placas sin inocular a 37°C por 24 horas en aerobiosis.
Obviamente se espera que no haya crecimiento de ningún tipo sobre la placa.
-Las especies de Proteus pueden desarrollarse en este medio y las características de sus colonias pueden confundirse con especies de Salmonella o Shigella. Por esta razón toda colonia sospechosa debe ser confirmada con pruebas bioquímicas.
-Es necesario acompañar el uso de este medio con otros agares menos selectivos, debido a que si el microorganismo buscado se encuentra en bajas concentraciones pudiera no desarrollarse en este medio.
-No sobrecalentar durante su preparación, ya que el calor excesivo altera la composición del medio.
-Inusualmente pueden aparecer colonias de Salmonella fermentadoras de lactosa que pueden pasar desapercibidas.
- Wikipedia contributors. Hektoen enteric agar. Wikipedia, The Free Encyclopedia. March 13, 2019, 23:38 UTC. Available at: .wikipedia.org/ Accessed March 16, 2019.
- Laboratorios BD. BD Hektoen Enteric Agar (HE Agar). 2013. Disponible en: bd.com
- Laboratorios Britania. Hektoen Entérico Agar. 2015. Disponible en: britanialab.com
- Laboratorios Difco Francisco Soria Melguizo. Agar Hektoen agar. Disponible en: f-soria.es
- Difco & BBL Manual, Hektoen Enteric Agar. 2nd Edition. Available in: bd.com/europe
