Óxido de boro (B2O3): estructura, propiedades y usos
El óxido de boro o anhídrido bórico es un compuesto inorgánico cuya fórmula química es B2O3. Al ser el boro y el oxígeno elementos del bloque p de la tabla periódica, y más aún cabezales de sus respectivos grupos, la diferencia de electronegatividad entre ellos no es muy alta; por lo tanto, es de esperarse que el B2O3 sea de naturaleza covalente.
El B2O3 se prepara disolviendo bórax en ácido sulfúrico concentrado dentro de un horno de fusión y a una temperatura de 750ºC; deshidratando térmicamente el ácido bórico, B(OH)3, a una temperatura de 300ºC aproximadamente; o también puede formarse como producto de la reacción del diborano (B2H6) con el oxígeno.

El óxido de boro puede tener una apariencia vidriosa semitransparente, o cristalina; esta última por molienda puede obtenerse en forma de polvo (imagen superior).
Aunque no lo parezca a primera vista, se considera el B2O3 como uno de los óxidos inorgánicos más complejos; no solo desde un punto de vista estructural, sino además debido a las variables propiedades que adquieren los vidrios y cerámicas a los cuales se les adiciona este a su matriz.
Índice del artículo
El B2O3 es un sólido covalente, por lo que en teoría no existen en su estructura iones B3+ ni O2-, sino enlaces B-O. El boro, de acuerdo a la teoría del enlace de valencia (TEV), solo puede formar tres enlaces covalentes; en este caso, tres enlaces B-O. Como consecuencia de esto, la geometría esperada debe ser trigonal, BO3.
La molécula de BO3 es deficiente de electrones, en especial los átomos de oxígeno; sin embargo, varias de ellas pueden interaccionar entre sí para surtir dicha deficiencia. Así, los triángulos BO3 se unen compartiendo un puente de oxígeno, y se distribuyen en el espacio como redes de hileras triangulares con sus planos orientados en distintas maneras.
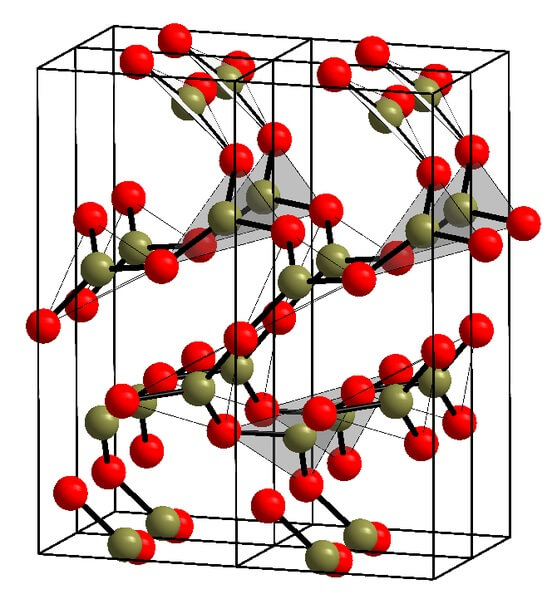
En la imagen superior se muestra un ejemplo de dichas hileras con unidades triangulares BO3. Si se observa con detenimiento, no todas las caras de los planos apuntan hacia el lector, sino a otro lado. Las orientaciones de estas caras pueden ser responsables de cómo está definido el B2O3 a cierta temperatura y presión.
Cuando estas redes tienen un patrón estructural a largo alcance, se trata de un sólido cristalino, el cual puede construirse a partir de su celda unitaria. Es aquí donde se dice que el B2O3 posee dos polimorfos cristalinos: el α y el β.
El α-B2O3 se produce a presión ambiente (1 atm), y se dice que es cinéticamente inestable; de hecho, esta es una de las razones por la que probablemente el óxido de boro sea un compuesto de difícil cristalización.
El otro polimorfo, el β-B2O3, se obtiene a altas presiones en el rango de GPa; por lo tanto, su densidad debe es mayor que la del α-B2O3.
Las redes BO3 naturalmente tienden a adoptar estructuras amorfas; estas son, que carecen de un patrón que describa las moléculas o iones en el sólido. Al sintetizarse el B2O3 su forma predominante es la amorfa y no la cristalina; en palabras correctas: es un sólido más vítreo que cristalino.
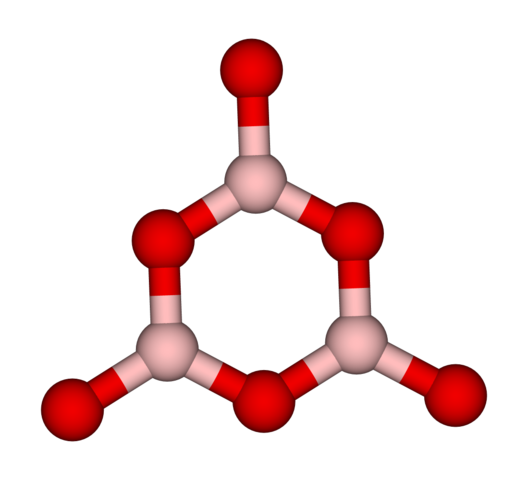
Se dice entonces que el B2O3 es vítreo o amorfo cuando sus redes de BO3 están desordenadas. No solo esto, sino que además, cambian el modo en cómo se unen. En lugar de ordenarse en una geometría trigonal, terminan por enlazarse para crear lo que llaman los investigadores un anillo de boroxol (imagen superior).
Nótese la evidente diferencia entre las unidades triangulares y las hexagonales. Las triangulares caracterizan al B2O3 cristalino, y las hexagonales al B2O3 vítreo. Otra manera de referirse a esta fase amorfa es vidrio de boro, o mediante una fórmula: g-B2O3 (la ‘g’ viene de la palabra glassy, en inglés).
Así, las redes del g-B2O3 están compuestas de anillos de boroxol y no de unidades BO3. Sin embargo, el g-B2O3 puede cristalizarse a α-B2O3, lo que implicaría una interconversión de anillos a triángulos, y definiría además el grado de cristalización alcanzado.
Es un sólido incoloro y vidrioso. En su forma cristalina es de color blanco.
69,6182 g/mol.
Ligeramente amargo
-Cristalino: 2,46 g/mL.
-Vítreo: 1,80g/mL.
No tiene un punto de fusión plenamente definido, debido a que depende de qué tan cristalino o vítreo sea. La forma puramente cristalina funde a 450ºC; sin embargo, la forma vítrea funde en un rango de temperaturas que abarca desde 300 hasta 700ºC.
Nuevamente, los valores reportados no coinciden en este valor. Al parecer el óxido de boro líquido (fundido de sus cristales o de su vidrio) hierve a 1860ºC.
Debe mantenerse seco, ya que absorbe humedad para transformarse en el ácido bórico, B(OH)3.
Al óxido de boro se le puede nombrar de otras maneras, tales como:
-Trióxido de diboro (nomenclatura sistemática).
-Óxido de boro (III) (nomenclatura stock).
-Óxido bórico (nomenclatura tradicional).
Algunos de los usos del óxido de boro son:
A partir del B2O3 puede sintetizarse trihalogenuros de boro, BX3 (X= F, Cl y Br). Estos compuestos son ácidos de Lewis, y con ellos es posible introducir átomos de boro a ciertas moléculas para obtener así otros derivados con nuevas propiedades.
Una mezcla sólida con el ácido bórico, B2O3-B(OH)3, representa una fórmula que se emplea como insecticida doméstico.
El óxido de boro líquido es capaz de disolver óxidos metálicos. De esta mezcla resultante, una vez enfriada, se obtienen sólidos compuestos por boro y metales.
Dependiendo de la cantidad de B2O3 utilizado, así como de la técnica, y el tipo de óxido metálico, puede obtenerse una rica variedad de vidrios (borosilicatos), cerámicas (nitruros y carburos de boro), y aleaciones (si se usan solo metales).
En general, el vidrio o la cerámica adquieren una mayor resistencia y fuerza, y además mayores durabilidades. Para el caso de los vidrios, terminan siendo utilizados para lentes ópticos y de telescopios, y para dispositivos electrónicos.
En la construcción de hornos de fundición de acero, se utilizan ladrillos refractarios con base de magnesio. En ellos se utiliza el óxido de boro como aglutinante, ayudando a mantenerlos fuertemente unidos.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Boron trioxide. Recuperado de: en.wikipedia.org
- PubChem. (2019). Boric oxide. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borix oxide. 20 Mule Team Borax. Recuperado de: borax.com
- A. Mukhanov, O. O. Kurakevich, y V. L. Solozhenko. (s.f.). On the Hardness of Boron (III) Oxide. LPMTMCNRS, Université Paris Nord, Villetaneuse, France.
- Hansen T. (2015). B2O3 (Boric Oxide). Recuperado de: digitalfire.com
