Triptófano: características, estructura, funciones, beneficios
El triptófano (Trp, W) es un aminoácido clasificado dentro del grupo de los aminoácidos esenciales, ya que el organismo humano no puede sintetizarlo y debe obtenerlo a través de la dieta.
Algunos alimentos como la leche y sus derivados, las carnes, los huevos y algunos cereales como la quinua y la soya contienen aminoácidos esenciales y, por ende, son una fuente importante de triptófano.
En la naturaleza se conocen más de 300 aminoácidos diferentes y de éstos sólo 22 constituyen las unidades monoméricas de las proteínas celulares. Entre estos últimos, 9 son aminoácidos esenciales, incluyendo al triptófano, sin embargo, la esencialidad de cada uno difiere entre una especie y otra.
El triptófano tiene diversas funciones, entre las que destacan su participación en la síntesis proteica, en la síntesis de la serotonina, que es un potente vasoconstrictor y neurotransmisor, de la melatonina y en la síntesis del cofactor NAD.
En el reino vegetal, el triptófano es un precursor fundamental de la hormona vegetal conocida como auxina (ácido indol-3-acético). Puede ser sintetizado por algunas bacterias como E. coli a partir del corismato, que es producido a partir de algunos derivados glucolíticos como el fosfoenolpiruvato y la eritrosa-4-fosfato.
Su degradación en los mamíferos ocurre en el hígado, donde se emplea para la síntesis de acetil coenzima A (acetil-CoA), y por esta razón se describe como un aminoácido denomina glucogénico, ya que puede entrar en el ciclo de formación de glucosa.
Se han reportado diversos estudios con resultados controversiales relacionados con el uso del triptófano como suplemento dietético para el tratamiento de algunas patologías como la depresión y algunos trastornos del sueño entre otras.
Existen algunas enfermedades relacionadas con defectos congénitos en el metabolismo de los aminoácidos. En el caso del triptófano se puede nombrar la enfermedad de Hartnup, por déficit de la triptófano-2,3-monooxigenasa, una enfermedad hereditaria recesiva que se caracteriza por retraso mental y alteraciones de la piel tipo pelagra.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en triptófano
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
Junto con la fenilalanina y la tirosina, el triptófano se encuentra en el grupo de los aminoácidos aromáticos e hidrófobos.
No obstante, el triptófano se caracteriza por ser un aminoácido ligeramente hidrofóbico ya que su cadena lateral aromática, por poseer grupos polares, atenúa esa hidrofobicidad.
Por tener anillos conjugados, éstos presentan una fuerte absorción de luz en la región del espectro cercano al ultravioleta y esta característica se usa frecuentemente para el análisis estructural de las proteínas.
Absorbe la luz ultravioleta (entre 250 y 290 nm) y, si bien este aminoácido no es muy abundante en la estructura de la mayor parte de las proteínas del cuerpo humano, su presencia representa una contribución importante para la capacidad de absorción de luz en la región de los 280 nm de la mayor parte de las proteínas.
Los requerimientos diarios de triptófano difieren con la edad. En los infantes entre 4 y 6 meses el requerimiento promedio es de unos 17 mg por kilogramo de peso por día; en niños de 10 a 12 años es de 3,3 mg por kilogramo de peso por día y en los adultos es de 3,5 mg por kilogramo de peso por día.
El triptófano se absorbe por vía intestinal y es un aminoácido cetogénico y glucogénico a la vez.
Ya que es precursor de la serotonina, un importante neurotransmisor, el triptófano debe llegar al sistema nervioso central (SNC) y para ello debe atravesar la barrera hematoencefálica, para lo cual existe un mecanismo de transporte activo específico.
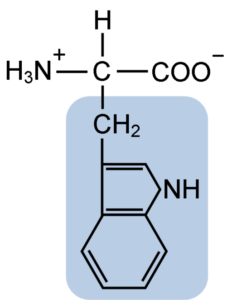
El triptófano tiene una fórmula molecular C11H12N2O2 y este aminoácido esencial posee una cadena lateral aromática.
Como todos los aminoácidos, el triptófano tiene un átomo de carbono α unido a un grupo amino (NH2), a un átomo de hidrógeno (H), un grupo carboxilo (COOH) y una cadena lateral (R) formada por una estructura heterocíclica, el grupo indol.
Su nombre químico es ácido 2-amino-3-indolil propiónico, tiene una masa molecular de 204,23 g/mol. Su solubilidad a 20 °C es de 1,06 g en 100 g de agua y tiene una densidad de 1,34 g/cm3.
En el ser humano, el triptófano se utiliza para la síntesis proteica y es indispensable para la formación de serotonina (5-hidroxitriptamina) un potente vasoconstrictor, estimulante de la contracción del músculo liso (sobre todo en el intestino delgado) y un neurotransmisor capaz de generar estimulación psíquica, combatir la depresión y regular la ansiedad.
El triptófano es un precursor en la síntesis de melatonina y, por ende, tiene implicaciones en los ciclos de sueño y vigilia.
Dicho aminoácido es utilizado como precursor en una de las tres vías para la formación del cofactor NAD, un cofactor muy importante que participa en gran variedad de reacciones enzimáticas relacionadas con eventos de óxido-reducción.
El triptófano y algunos de sus precursores son utilizados para la formación de una hormona vegetal denominada auxina (ácido indol-3-acético). Las auxinas son hormonas vegetales que regulan el crecimiento, el desarrollo y muchas otras funciones fisiológicas de las plantas.
En los organismos capaz de sintetizarlo, el esqueleto carbonado del triptófano deriva del fosfoenolpiruvato y de la eritrosa-4-fosfato. Estos, a su vez, se forman a partir de un intermediario del ciclo de Krebs: el oxalacetato.
El fosfoenolpiruvato y la eritrosa-4-fosfato se utilizan para la síntesis de corismato en una ruta de siete pasos enzimáticos. El fosfoenolpiruvato (PEP) es un producto de la glicólisis y la eritrosa-4-fosfato de la ruta de las pentosas fosfato.
El primer paso de la síntesis de corismato es la unión del PEP con la eritrosa-4-fosfato para formar 2-ceto-3-desoxi-D-arabino-heptulosonato-7-fosfato (DAHP).
Esta reacción es catalizada por la enzima 2-ceto-3-desoxi-D-arabino-heptulosonato-7-fosfato sintasa (DAHP sintasa), que es inhibida por el corismato.
La segunda reacción implica la ciclación del DAHP por la deshidroquinato sintasa, una enzima que requiere del cofactor NAD, que se reduce durante esta reacción; como resultado se produce 5-deshidroquinato.
El tercer paso de esta ruta implica la eliminación de una molécula de agua del 5-deshidroquinato, reacción catalizada por la enzima deshidroquinato deshidratasa, cuyo producto final corresponde al 5-deshidro shikimato.
El grupo ceto de esta molécula es reducido a un grupo hidroxilo y, como consecuencia, se forma el shikimato. La enzima que cataliza esta reacción es la shikimato deshidrogenasa NADPH-dependiente.
El quinto paso de la ruta implica la formación de shikimato 5-fosfato y el consumo de una molécula de ATP por acción de una enzima conocida como shikimato quinasa, encargada de la fosforilación del shikimato en posición 5.
Posteriormente, a partir del shikimato 5-fosfato y por acción de la 3-enolpiruvil shikimato-5-fosfato sintasa, se genera 3-enolpiruvil shikimato 5-fosfato. La enzima mencionada promueve el desplazamiento del grupo fosforilo de una segunda molécula de PEP por el grupo hidroxilo del carbono en posición 5 del shikimato 5-fosfato.
La séptima y última reacción es catalizada por la corismato sintasa, que elimina el fosfato del 3-enolpiruvil shikimato 5-fosfato y lo convierte en corismato.
En el hongo N. crassa, un solo complejo enzimático multifuncional cataliza cinco de las siete reacciones de esta ruta y a este complejo se le suman otras tres enzimas que terminan generando triptófano.
En E. coli, la transformación del corismato a triptófano incluye una ruta de cinco pasos enzimáticos adicionales:
Primero, la enzima antranilato sintasa convierte el corismato en antranilato. En esta reacción participa una molécula de glutamina, que dona el grupo amino que se une al anillo indol del triptófano y se convierte en glutamato.
El segundo paso es catalizado por la antranilato fosforribosil transferasa. En esta reacción se desplaza una molécula de pirofosfato del 5-fosforribosil-1-pirofosfato (PRPP) un metabolito rico en energía, y se forma el N-(5′-fosforribosil)-antranilato.
La tercera reacción de esta ruta de síntesis de triptófano implica la participación de la enzima fosforribosil-antranilato isomerasa. Aquí se abre el anillo furano del N-(5′-fosforribosil)-antranilato y se forma por tautomerización la 1-(o-carboxifenilamino)-1-desoxirribulosa 5-fosfato.
Más adelante se forma el indol-3-glicerol fosfato, en una reacción catalizada por la indol-3-glicerol fosfato sintasa, donde se libera un CO2 y una molécula de H2O y se cicla la 1-(o-carboxifenilamino)-1-desoxirribulosa 5-fosfato.
La última reacción de esta vía termina formando triptófano cuando la triptófano sintasa cataliza la reacción del indol-3-glicerol fosfato con una molécula de PLP (piridoxal fosfato) y otra de serina, liberándose gliceraldehido 3-fosfato y formándose triptófano.
En los mamíferos el triptófano es degradado en el hígado hasta acetil-CoA en una ruta que involucra doce pasos enzimáticos: ocho para llegar a α-cetoadipato y 4 más para convertir el α-cetoadipato en acetil coenzima A.
El orden de degradación hasta α-cetoadipato es:
Triptófano → N-formil quinurenina → Quinurenina → 3-hidroxi quinurenina → 3-hidroxi-antranilato → ε-semialdehído 2-amino-3-carboxi mucónico → ε-semialdehído α-amino mucónico → 2-amino muconato → α-cetoadipato.
Las enzimas que catalizan estas reacciones respectivamente son:
La triptófano 2-3-dioxigenasa, la quinurenina formamidasa, la monooxigenasa dependiente de NADPH, la quinureninasa, la 3-hidroxi-antranilato oxigenasa, la descarboxilasa, la ε-semialdehído α-aminonucónico deshidrogenasa NAD-dependiente y la α-amino muconato reductasa NADPH-dependiente.
Una vez generado el α-cetoadipato, por descarboxilación oxidativa se forma glutaril-CoA. Este, por ß-oxidación, forma Glutaconil-CoA que pierde un átomo de carbono en forma de bicarbonato (HCO3-), gana una molécula de agua y termina como crotonil-CoA.
El crotonil-CoA, también por ß-oxidación, rinde acetil-CoA. Dicho acetil-CoA puede seguir varias vías entre las que se destaca la gluconeogénesis, para formar glucosa y el ciclo de Krebs, para formar ATP, según sea necesario.
Sin embargo, esta molécula también puede ser dirigida hacia la formación de cuerpos cetónicos, que finalmente pueden ser empleados como fuente de energía.
Las carnes rojas en general, el pollo y el pescado (sobre todo los pescados azules como el salmón y el atún) son especialmente ricos en triptófano. La leche y sus derivados, los huevos, sobre todo la yema, también son alimentos con abundante contenido de triptófano.
Otros alimentos que sirven como fuente natural de este aminoácido son:
– Los frutos secos como las nueces, las almendras, los pistachos y los anacardos, entre otros.
– Los cereales de arroz.
– Los granos secos como los frijoles, las lentejas, los garbanzos, la soja, la quinua, etc.
– La levadura de cerveza y las habas frescas, los bananos y los plátanos, la piña o ananá, el aguacate, las ciruelas, los berros, el brócoli, las espinacas y el chocolate.
El consumo de triptófano es absolutamente necesario para sintetizar todas aquellas proteínas que lo incluyan en su estructura y a través de sus diferentes funciones permite regular el estado de ánimo, los ciclos de sueño y vigilia y una gran variedad de procesos bioquímicos en los que participa el NAD.
Además de los efectos conocidos sobre el estado de ánimo, la serotonina (derivada del triptófano) interviene en múltiples funciones cognitivas relacionadas con el aprendizaje y la memoria que, por ende, se relacionan también con el triptófano.
Existen datos que muestran la relación entre el estado de ánimo, la serotonina y el eje gastrointestinal-cerebral como un sistema de influencias bidireccionales entre los centros emocionales y cognitivos cerebrales y la función periférica del tracto digestivo.
El uso como suplemento dietético para el tratamiento de algunos trastornos, especialmente los relacionados con el sistema nervioso central, ha sido muy controversial debido a que su transporte competitivo con los aminoácidos neutros, mucho más abundantes, hace que sea difícil lograr aumentos significativos y sostenidos de triptófano tras su administración oral.
A pesar de estas controversias se ha postulado su uso como coadyuvante en:
– Tratamiento del dolor
– Trastornos del sueño
– Tratamiento de la depresión
– Tratamiento de las manías
– Reducción del apetito
La eliminación o carencia central de triptófano se acompaña de depresión, fallas en la atención, disminución de la memoria, trastornos del sueño y ansiedad.
En pacientes deprimidos y con tendencias suicidas se han encontrado alteraciones en la concentración de triptófano sanguínea y del líquido cefalorraquídeo. Además, algunos pacientes con anorexia nerviosa muestran bajos niveles séricos de triptófano.
Algunos pacientes poliúricos, que pierden vitamina B6 y zinc, frecuentemente presentan fobias y ansiedad y mejoran con suplementos dietéticos ricos en triptófano.
El síndrome carcinoide se caracteriza por la presencia de pequeños tumores intestinales que causan diarreas, enfermedades vasculares y broncoconstricción y está relacionado con el déficit de niacina y de triptófano
La pelagra es una condición patológica que se acompaña de diarrea, demencia, dermatitis y puede causar la muerte, esta también se trata con suplementos de niacina y triptófano.
La enfermedad de Hartnup tiene que ver, entre algunas cosas, con un defecto en el metabolismo de varios aminoácidos, incluyendo al triptófano.
En el caso por déficit de la enzima triptófano-2,3-monooxigenasa, esta es una enfermedad hereditaria recesiva que se caracteriza por retraso mental y alteraciones de la piel tipo pelagra.
- Halvorsen, K., & Halvorsen, S. (1963). Hartnup disease. Pediatrics, 31(1), 29-38.
- Hood, S. D., Bell, C. J., Argyropoulos, S. V., & Nutt, D. J. (2016). Don’t panic. A guide to tryptophan depletion with disorder-specific anxiety provocation. Journal of Psychopharmacology, 30(11), 1137-1140.
- Jenkins, T. A., Nguyen, J. C., Polglaze, K. E., & Bertrand, P. P. (2016). Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis. Nutrients, 8(1), 56.
- Kaye, W. H., Barbarich, N. C., Putnam, K., Gendall, K. A., Fernstrom, J., Fernstrom, M., … & Kishore, A. (2003). Anxiolytic effects of acute tryptophan depletion in anorexia nervosa. International Journal of Eating Disorders, 33(3), 257-267.
- Murray, R. K., Granner, D. K., Mayes, P., & Rodwell, V. (2009). Harper’s illustrated biochemistry. 28 (p. 588). New York: McGraw-Hill.
- Nelson, D. L., Lehninger, A. L., & Cox, M. M. (2008). Lehninger principles of biochemistry. Macmillan.
