Ácido fosfórico: qué es, estructura, propiedades y usos
¿Qué es el ácido fosfórico?
El ácido fosfórico es un oxoácido del fósforo que tiene por fórmula química H3PO4. Consiste en un ácido mineral en el que tres protones ácidos están enlazados al anión fosfato (PO43–). Aunque no se considera un ácido fuerte, su uso inadecuado puede presentar un riesgo para la salud.
Puede encontrarse en dos estados: como un sólido bajo la forma de cristales ortorrómbicos gruesos, o como un líquido cristalino de aspecto de jarabe. Su presentación comercial más usual tiene una concentración del 85% p/p y una densidad de 1,685 g/cm3. Dicha densidad viene de la mano de la concentración.
Los tres grupos OH son los responsables de donar los hidrógenos ácidos. Debido a la presencia de ellos en su estructura, puede reaccionar con diferentes hidróxidos originando varias sales.
En el caso del hidróxido de sodio, puede formar tres: fosfato monobásico de sodio (NaH2PO4), fosfato dibásico de sodio (Na2HPO4) y fosfato tribásico de sodio (Na3PO4).
No obstante, dependiendo de cuál base se utilice para su neutralización, o qué cationes estén muy cerca de él, puede formar otras sales de fosfatos. Entre ellas están: fosfato de calcio (Ca3(PO4)2), fosfato de litio (Li3PO4), fosfato férrico (FePO4), y otras. Cada una con sus distintos grados de protonación del anión fosfato.
Por otro lado, el ácido fosfórico puede “secuestrar” cationes divalentes como el Fe2+, Cu2+, Ca2+ y Mg2+. A temperaturas elevadas puede reaccionar consigo mismo con la pérdida de una molécula de H2O formando dímeros, trímeros y polímeros de ácidos fosfóricos.
Este tipo de reacción hace que este compuesto sea capaz de establecer un gran número de estructuras con esqueletos de fósforo y oxígeno, de las cuales también pueden obtenerse una amplia gama de sales conocidas, como los polifosfatos.
Respecto a su descubrimiento, fue sintetizado en 1694 por Robert Boyle (1627-1691), disolviendo P2O5 (pentóxido de fósforo) en agua. Es uno de los ácidos minerales con mayor utilidad, siendo su función como fertilizante la de mayor importancia.
El fósforo, el potasio y el nitrógeno constituyen los tres principales nutrientes de las plantas.
Estructura química del ácido fosfórico
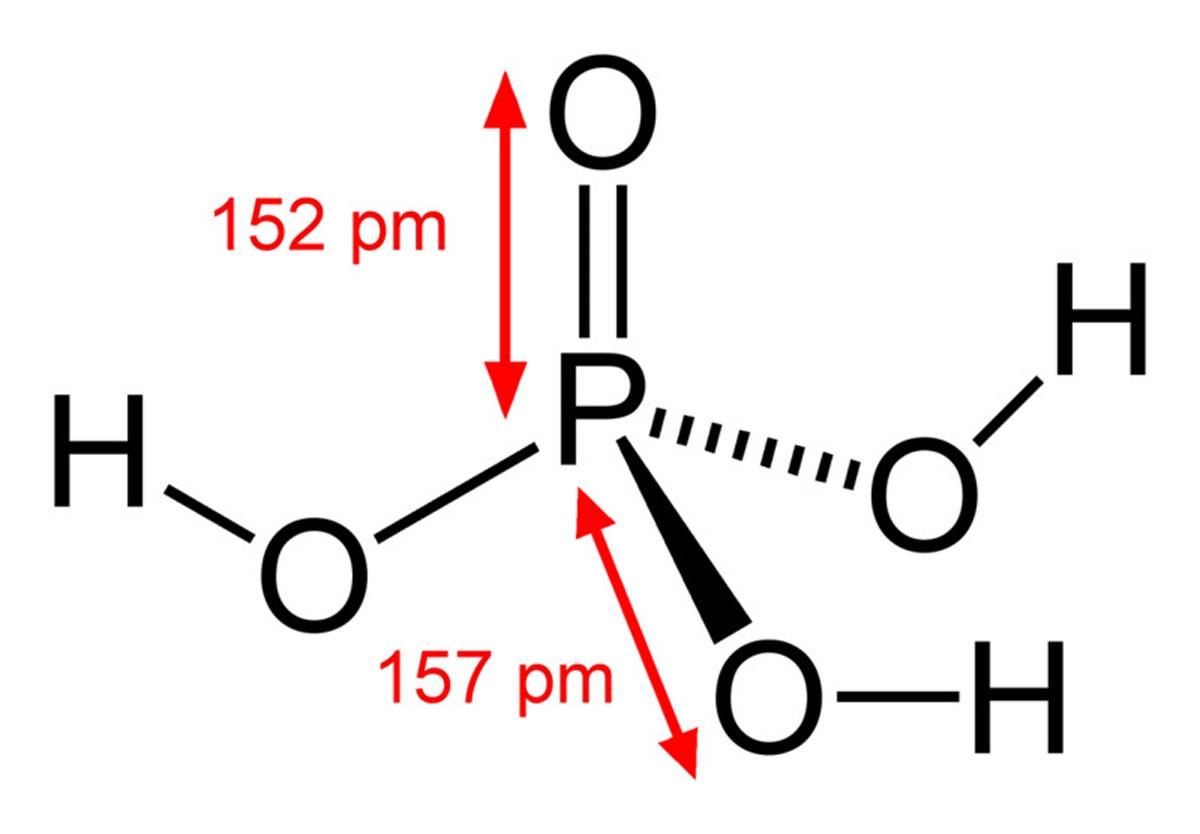
El ácido fosfórico consiste en un enlace P=O y tres P–OH, donde estos últimos son los portadores de los hidrógenos ácidos liberados en un medio de disolución. Con el átomo de fósforo situándose en el centro, los oxígenos dibujan una especie de tetraedro molecular.
De esta manera, el ácido fosfórico puede visualizarse como un tetraedro. Desde esta perspectiva dichos tetraedros (por unidades de H3PO4) interaccionan unos con otros mediante puentes de hidrógeno; es decir, sus vértices se aproximan estrechamente.
Estas interacciones intermoleculares permiten que el ácido fosfórico cristalice en dos sólidos: el anhidro y el hemihidrato (H3PO4·1/2H2O), ambos con sistemas cristalinos monoclínicos. Su forma anhidra también puede describirse con la fórmula: 3H2O·P2O5, lo que es igual a un pentóxido de fósforo tri-hidratado.
Los tetraedros pueden llegar incluso a enlazarse covalentemente, pero para ello una de sus unidades debe eliminar una molécula de agua mediante la deshidratación. Esto ocurre cuando el H3PO4 se somete a calentamiento, y genera como consecuencia la formación de ácidos polifosfóricos (PA).
Ácido difosfórico (H4P2O7)
El más simple de todos los PA es el ácido difosfórico (H4P2O7), también conocido como ácido pirofosfórico. La ecuación química de su formación es la siguiente:
2H3PO4 => H4P2O7 + H2O
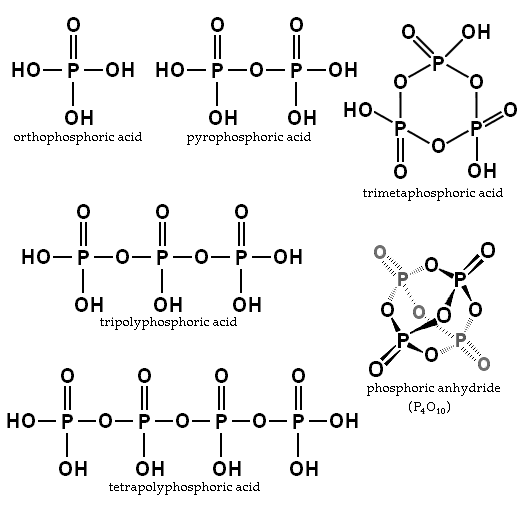
El equilibrio depende de la cantidad de agua y la temperatura. ¿Cuál es su estructura? En la imagen del apartado se ilustran en la esquina superior izquierda las estructuras del ácido ortofosfórico y del pirofosfórico.
Dos unidades se unen covalentemente al eliminarse una molécula de agua, formándose un puente de oxígeno P–O–P entre ellas. Ahora no son tres hidrógenos ácidos, sino cuatro (cuatro grupos –OH). Debido a esto, el H4P2O7 presenta cuatro constantes de ionización ka.
Ácidos polifosfóricos
La deshidratación puede proseguir con el ácido pirofosfórico si el calentamiento continúa. ¿Por qué? Porque en cada extremo de su molécula hay un grupo OH que puede eliminarse como molécula de agua, promoviendo así el posterior crecimiento del esqueleto P–O–P–O–P…
Ejemplos de estos ácidos son los ácidos tripolifosfórico y tetrapolifosfórico (ambos ilustrados también en la imagen previa). Puede observarse cómo el esqueleto P–O–P se alarga en una especie de cadena conformada por tetraedros.
Estos compuestos pueden representarse con la fórmula HO(PO2OH)xH, donde HO es el extremo izquierdo que puede deshidratarse. PO2OH es el esqueleto de fósforo con los enlaces P=O y OH; y x son las unidades o moléculas de ácidos fosfóricos necesarias para la obtención de dicha cadena.
Cuando estos compuestos se neutralizan con una base completamente, se originan los llamados polifosfatos. Dependiendo de qué cationes los rodeen, forman una amplia variedad de sales de polifosfatos.
Por otro lado, si reaccionan con alcoholes ROH, los hidrógenos de su esqueleto se sustituyen por los sustituyentes alquílicos R–. Así, surgen los ésteres de fosfatos (o polifosfatos): RO(PO2OR)xR. Basta con sustituir los H por R en todas las estructuras de la imagen del apartado para obtenerlos.
Ácidos polifosfóricos cíclicos
Las cadenas P–O–P pueden incluso cerrarse en un anillo o ciclo fosfórico. El más simple de este tipo de compuesto es el ácido trimetafosfórico (esquina superior derecha de la imagen). Así, los PA pueden ser lineales, cíclicos; o si sus estructuras exhiben ambos tipos, ramificados.
Nomenclatura
La nomenclatura del ácido fosfórico viene dictaminada por la IUPAC y el cómo se nombran las sales ternarias de los oxoácidos.
Debido a que en el H3PO4 el átomo de P tiene valencia +5, la de mayor valor, a su ácido se le asigna el sufijo –ico al prefijo fosfor-.
Orto-
Sin embargo, al ácido fosfórico también se le dice comúnmente ácido ortofosfórico. ¿Por qué? Porque la palabra ‘orto’ es griega y significa ‘verdadero’; lo que se traduciría en la “forma verdadera” o “más hidratada” del mismo.
Cuando el anhidro fosfórico se hidrata con un exceso de agua (P4O10, la “gorra” de fósforo de la imagen superior) se produce H3PO4 (3H2O·P2O5). Así, se le adjudica el prefijo orto- a aquellos ácidos formados con abundante agua.
Piro-
El prefijo piro- se refiere a todo compuesto originado tras la aplicación de calor, ya que el ácido difosfórico surge a partir de la deshidratación térmica del ácido fosfórico. Se le llama por lo tanto ácido pirofosfórico (2H2O·P2O5).
Meta-
El prefijo meta, que también es una palabra griega, significa ‘después’. Se agrega a aquellas sustancias cuya fórmula ha eliminado una molécula, en este caso, la del agua:
H3PO4 => HPO3 + H2O
Nótese que esta vez no ocurre la adición de dos unidades fosfóricas para formar el ácido difosfórico, sino que en lugar de eso se obtiene el ácido metafosfórico (del cual no hay evidencias de su existencia).
Asimismo es importante resaltar que este ácido puede describirse como H2O·P2O5 (parecido al hemidrato, multiplicando HPO3 por 2). El prefijo meta- viene perfectamente acorde a los PA cíclicos, ya que si el ácido trifosfórico se deshidrata, pero no agrega otra unidad H3PO4 para convertirse en ácido tetrafosfórico, entonces debe formar un anillo.
Y así ocurre igual con otros ácidos polimetafosfóricos, aunque la IUPAC recomienda llamarlos como compuestos cíclicos de los correspondientes PA.
Propiedades del ácido fosfórico
Fórmula molecular
H3PO4
Peso molecular
97,994 g/mol
Aspecto físico
En su forma sólida presenta cristales ortorrómbicos, higroscópicos y transparentes. Bajo la forma líquida es cristalino, de aspecto de jarabe viscoso.
Comercialmente se consigue en disolución acuosa con una concentración del 85% p/p. En todas estas presentaciones carece de olor.
Puntos de ebullición y de fusión
158º C (316º F a 760 mmHg).
108º F (42,2º C).
Solubilidad en agua
548 g/100 g de H2O a 20º C; 369,4 g/100 ml a 0,5º C; 446 g/100m a 14,95º C.
Densidad
1,892 g/cm3 (sólido); 1,841 g/cm3 (solución al 100%); 1,685 g/cm3 (solución al 85%); 1,334 g/cm3 solución al 50%) a 25ºC.
Densidad del vapor
Relativo al aire 3,4 (aire = 1).
Auto ignición
No es inflamable.
Viscosidad
3,86 mPoise (solución al 40% a 20º C).
Acidez
pH: 1,5 (solución 0,1 N en agua)
pKa: pKa1= 2,148; pKa2= 7,198 y pKa3= 12,319. Por consiguiente, su hidrógeno más ácido es el primero.
Descomposición
Al calentarse libera óxidos de fósforo. Si la temperatura se eleva a 213º C o más se convierte en ácido pirofosfórico (H4P2O7).
Corrosividad
Corrosivo a metales ferrosos y aluminio. Al reaccionar con estos metales se origina el gas combustible hidrógeno.
Polimerización
Polimeriza violentamente con compuestos azo, epóxidos y compuestos polimerizables.
Usos del ácido fosfórico
Sales de fosfatos y usos generales
-El ácido fosfórico sirve de base para la elaboración de fosfatos, los cuales se emplean como fertilizantes debido a que el fósforo es un nutriente principal de las plantas.
-Ha sido usado en el tratamiento de envenenamiento con plomo y otras condiciones en las cuales se requieren cantidades importantes de fosfato y la producción de una acidosis leve.
-Se utiliza para controlar el pH del tracto urinario de visones y gatos con el fin de evitar la formación de cálculos renales.
-El ácido fosfórico origina las sales Na2HPO4 y NaH2PO4 que constituyen un sistema amortiguador del pH con un pKa de 6,8. Este sistema regulador del pH está presente en el humano, teniendo importancia en la regulación del pH intracelular, así como en el manejo de la concentración de hidrógeno en los túbulos distal y colector de las nefronas.
-Se utiliza en la eliminación de la capa mohosa de óxido de hierro que se acumula sobre este metal. El ácido fosfórico forma fosfato de hierro, que puede ser retirado fácilmente de la superficie metálica. También se utiliza en el pulido eléctrico del aluminio y es un agente enlazante de productos refractarios, como la alúmina y la magnesia.
Industriales
-El ácido fosfórico es destinado como agente catalítico en la elaboración del nylon y la gasolina. Se usa como agente deshidratante en el grabado litográfico, en la elaboración de tintes para su uso en la industria textil, en el proceso de coagulación del látex en la industria cauchera y en la purificación del peróxido de hidrógeno (agua oxigenada).
-El ácido se emplea como aditivo en las bebidas gaseosas contribuyendo de esta manera a su sabor. Diluido, se aplica en el proceso de refinación del azúcar. Asimismo, actúa como sistema amortiguador en la preparación del jamón, la gelatina y los antibióticos.
-Interviene en la elaboración de los detergentes, en la catálisis ácida de la producción del acetileno.
-Se usa como acidulante en alimentos balanceados destinados a la industria ganadera y las mascotas. La industria farmacéutica lo utiliza en la fabricación de medicamentos antieméticos. También se aprovecha en una mezcla para fabricar asfalto para pavimentar el suelo y reparar las grietas.
-El ácido fosfórico actúa como catalizador en la reacción de hidratación de los alquenos para producir alcohol, principalmente etanol. Además, se utiliza en la determinación de carbón orgánico en suelos.
Odontológicos
Es usado por los odontólogos para limpiar y acondicionar la superficie dental antes de la colocación de los soportes dentales. Asimismo encuentra uso en el blanqueamiento dental y en la eliminación de las placas dentales. Además, se utiliza en la fabricación de pegamentos para las prótesis dentales.
Cosméticos
El ácido fosfórico es usado para ajustar el pH en la elaboración de productos cosméticos y para el cuidado de la piel. Es usado como un agente oxidante químico para la producción de carbón activado.
Formación del ácido fosfórico
-Se prepara ácido fosfórico a partir de rocas de fosfato del tipo apatita, mediante su digestión con ácido sulfúrico concentrado:
Ca3(PO4)2 + 3 H2SO4 + 6 H2O => 2 H3PO4 + 3 (CaSO4.2H2O)
El ácido fosfórico obtenido en esta reacción es de baja pureza, por lo que se somete a un proceso de purificación que incluye precipitación, extracción con solvente, cristalización y técnicas de intercambio iónico.
-Se puede producir ácido fosfórico disolviendo el pentóxido de fósforo en agua hirviente.
-También puede obtenerse calentando fósforo con una mezcla de aire y vapor de agua:
P4 (l) + 5 O2 (g) => P4O10 (s)
P4O10 (s) + H2O (g) => 4H3PO4 (l)
Riesgos
-Debido a que su presión de vapor es baja a temperatura ambiente, es poco probable que puedan inhalarse sus vapores, a menos que se rocíe el ácido. De ser así, los síntomas de su inhalación comprenden: tos, dolor de garganta, acortamiento de la respiración y respiración trabajosa.
-En la literatura se cita el caso de un marinero que estuvo expuesto a vapores de ácido fosfórico por un largo período de tiempo. Sufrió debilidad general, tos seca, dolor torácico y problemas respiratorios. Al cabo de un año de la exposición, se observó una disfunción reactiva de las vías respiratorias.
-El contacto cutáneo con el ácido fosfórico puede producir enrojecimiento, dolor, ampollas y quemaduras de la piel.
-El contacto del ácido con los ojos, dependiendo de su concentración y la duración del contacto, puede producir en estos, lesiones corrosivas tisulares o quemaduras severas con daño ocular permanente.
-La ingestión del ácido provoca quemadura en la boca y garganta, sensación de ardor más allá del esternón, dolor abdominal, vómitos, shock y colapso.
Referencias
- Royal Society of Chemistry. (2015). Phosphoric acid. Tomado de: chemspider.com
- Centro Canadiense de Salud y Seguridad Ocupacional. (1999). Ácido fosfórico – Efectos en la Salud. Tomado de: ccsso.ca
- Acidos.Info. (2018). Ácido fosfórico » Variedad De Usos De Este Compuesto Químico. Tomado de: acidos.info
- James P. Smith, Walter E. Brown, and James R. Lehr. (1955). Structure of Crystalline Phosphoric Acid. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Phosphoric acids and phosphates. Tomado de: en.wikipedia.org
- Science is Fun. Learn About Phosphoric Acid. [PDF]. Tomado de: scifun.chem.wisc.edu
