Histidina: características, estructura, funciones, alimentos
La histidina (His, H) es un aminoácido que se utiliza para la síntesis de proteínas. Es una molécula hidrofílica, por lo que generalmente está orientado hacia la parte externa de las estructuras proteicas cuando estas se encuentran en un medio líquido.
Se considera un aminoácido esencial para los niños en crecimiento ya que no lo producen. En el adulto existe una pequeña producción de histidina, pero es insuficiente para abastecer los requerimientos diarios por lo que se considera un aminoácido semi esencial.
Para los animales y el hombre, la histidina es un aminoácido esencial o al menos semi esencial, sin embargo, las plantas, los hongos y los microorganismos producen eficientemente la histidina que necesitan y son parte de las fuentes dietéticas de histidina, además de las proteínas animales.
La histidina cumple funciones fisiológicas muy importantes en el ser humano como son: las de formar parte de los centros activos de muchas enzimas, participar en el crecimiento, en el sistema inmunitario y en la formación de la mielina en las fibras nerviosas, entre otras.
La biosíntesis de la histidina es un proceso complejo que tiene lugar principalmente en el hígado y que requiere de 9 a 11 pasos enzimáticos. Su degradación se produce en el hígado y la piel y pasa por la formación de glutamato, siguiendo luego diferentes vías.
Muchos alimentos son ricos en histidina, como por ejemplo las proteínas animales como la carne y los productos lácteos, así como las proteínas vegetales. Estos aportan gran parte de los requerimientos diarios de histidina que nuestro cuerpo necesita para funcionar correctamente.
El déficit o el exceso de histidina ocasionado por problemas hereditarios metabólicos o de transporte, o la falla dietética en la ingesta, se relacionan con algunos problemas importantes que afectan la salud tanto en niños como en adultos. El consumo suficiente de histidina permite mantener una vida sana y saludable en la mayor parte de los casos.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en histidina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
Una característica resaltante de la histidina es que puede ser convertida en histamina, una sustancia que participa activamente en muchas reacciones alérgicas e inflamatorias.
En el pescado expuesto al ambiente sin refrigeración suficiente las bacterias pueden convertir la histidina en histamina y es por ello que, al ser ingeridos, causan intoxicación alimentaria.
Otra característica de este aminoácido es que es uno de los pocos, entre los 22 existentes, que en el rango del pH fisiológico (alrededor de 7.4) se ioniza y, por lo tanto, puede participar activamente en el sitio catalítico de muchas enzimas.
En la molécula de hemoglobina la histidina proximal es uno de los ligandos del grupo hemo. En otras palabras, este aminoácido participa en la función de transporte de oxígeno de la hemoglobina y es indispensable para la síntesis de esta proteína, así como para la de la mioglobina, que también se conoce con el nombre de “hemoglobina muscular”.
La histidina es un aminoácido hidrofílicopolarbásico, clasificado dentro de los aminoácidos esenciales, ya que no puede ser sintetizada por los animales. No obstante, y como se comentó con anterioridad, es sintetizado por bacterias, hongos y plantas.
En los niños en crecimiento, la histidina es absolutamente necesaria; el adulto puede sintetizarla, pero no está claro si esto cubre las necesidades diarias de histidina, por lo que debe ser ingerida con la dieta.
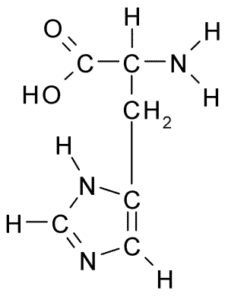
Como todos los aminoácidos, la histidina tiene un carbono α al que se une un grupo amino, un grupo carboxilo, un átomo de hidrógeno y una cadena lateral.
La cadena lateral de este aminoácido está formada por un anillo de imidazol que, a pH fisiológico, se protona y adquiere carga positiva y se denomina “imidazolio” abreviado como ImH+.
Junto con la lisina y la arginina, la histidina forma el grupo de los aminoácidos básicos. De los tres, la histidina es la menos básica y su anillo imidazólico se puede desprotonar a pH cercanos a 6.
Puesto que a pH fisiológico la histidina puede intercambiar protones, esta suele participar en las catálisis enzimáticas que implican la transferencia de protones. Además, ya que se trata de un aminoácido polar, suele hallarse en la superficie externa de las proteínas, donde puede hidratarse en un medio acuoso.
La histidina es necesaria para la síntesis de muchas proteínas, especialmente enzimas cuyos centros activos tienen en su estructura a este aminoácido. Forma parte del centro activo de las aldolasas de los mamíferos, donde funciona como donador de protones.
Se encuentra en el centro activo de la carboxipeptidasa A, una enzima pancreática que tiene un sitio activo formado por Zn e histidina. En la enzima glicolítica fosfoglicerato mutasa existen dos residuos de histidina en su centro activo que actúan como aceptores o donadores de grupos fosforilo.
También se encuentra en el sitio activo de enzimas como la gliceraldehido 3-fosfato deshidrogenasa, la lactato deshidrogenasa, la papaína, la quimotripsina, la RNasa A y la histidina amoníaco liasa (histidasa). Además, es un inhibidor alostérico de la enzima glutamina sintetasa.
Este aminoácido es de gran importancia para el organismo, ya que su descarboxilación por la histidina descarboxilasa produce histamina, un potente vasodilatador relacionado con las reacciones inflamatorias y alérgicas, presente en el intestino y los gránulos de las células del sistema fagocítico mononuclear.
La histidina es producida por las neuronas del sistema nervioso central con funciones neuromoduladoras.
Es necesaria para la formación de las vainas de mielina de las fibras nerviosas, por lo que cumple un importante rol en la transmisión de los impulsos eléctricos en las mismas.
Junto con la hormona de crecimiento y otros aminoácidos, la histidina contribuye a los mecanismos de reparación tisular, principalmente en el sistema cardiovascular.
Algunas funciones adicionales incluyen:
– Contribuye con la desintoxicación de algunos metales pesados ya que actúa como quelante.
– Protege contra los daños provocados por la radiación.
– Participa en la formación de glóbulos rojos y blancos.
– Es necesaria para la formación de la hemoglobina.
– Ayuda a combatir algunos efectos negativos de la artritis reumatoide como la inflamación y la falta de movilidad.
– Es un aminoácido importante para la regeneración capilar, el crecimiento y para la función sexual.
La carnosina, la anserina y la homocarnosina, son dipéptidos formados a partir de histidina. Los dos primeros se encuentran en los músculos y tienen funciones importantes como tamponadores y como activadores de la miosina ATPasa.
La homocarnosina se produce en el encéfalo en cantidades 100 veces superiores a la carnosina del músculo esquelético.
La histidina obtiene su esqueleto carbonado a partir de la ribosa 5-fosfato. En la bacteria E. Coli, este aminoácido se produce a partir de dicho compuesto por medio de 11 pasos enzimáticos:
- El primer paso de la síntesis consiste en la transferencia de un fosforribosil del ATP al carbono 1 de la ribosa 5-fosfato, generando 5-fosforribosil-1-pirofosfato (PRPP). La enzima fosforribosil-pirofosfato sintetasa (PRPP sintetasa) cataliza esta reacción.
- Luego ocurre la transferencia del grupo pirofosfato del carbono 1 al N-1 del ATP, y se produce el N1-(5’-fosforribosil)-ATP. La enzima que cataliza esta reacción es la ATP fosforribosiltransferasa.
- Por acción de la fosforribosil-ATP-pirofosfato hidroxilasa se hidroliza el enlace α,β-pirofosfato del ATP y se forma el N1-(5’-fosforribosil)-AMP.
- La enzima fosforribosil-AMP ciclo hidroxilasa abre el anillo de purina entre el N-1 y el C-6 y se forma el ribonucleótido N1-(5’-fosforribosil formimino)-5-aminoimidazol-4-carboxamida-1-ribonucleótido.
- Entonces, se abre el anillo de ribofuranosa que proviene del PRPP y se isomeriza a una cetosa, formándose el N1-(5’-fosforribosil formimino)-5-aminoimidazol-4-carboxamida-1-ribonucleótido por efecto de una enzima isomerasa.
- La enzima aminotransferasa transfiere el grupo amido de la glutamina, que se convierte en glutamato, y rompe el enlace formimino, por lo que se libera 5-aminoimidazol-carboxamida-1-ribonucleótido y se genera el imidazol-glicerol fosfato.
- Se elimina una molécula de agua del imidazol-glicerol fosfato por medio de la imidazol-glicerol fosfato deshidratasa y se forma imidazol-acetol fosfato.
- Al imidazol-acetol fosfato se le transfiere un grupo amino por medio de la histidinol fosfato transaminasa y se forma el histidinol fosfato.
- Se hidroliza el grupo de éster fosfórico del histidinol fosfato para formar histidinol. La histidinol fosfato fosfatasa cataliza esta reacción.
- Más adelante, el histidinol es oxidado por la histidinol deshidrogenasa y se forma histidinal.
- La misma histidinol deshidrogenasa oxida al histidinal y lo convierte en histidina.
La primera enzima de la ruta biosintética de la histidina es inhibida por el producto de la ruta, es decir, la histidina participa en la inhibición alostérica de la ATP fosforribosiltransferasa, lo que representa el principal mecanismo de regulación de la ruta.
La histidina, la prolina, el glutamato, la arginina y la glutamina son aminoácidos que al degradarse terminan formando α-cetoglutarato. Cuatro de ellos se convierten primero en glutamato, que por transaminación da origen al α-cetoglutarato.
La histidina, por medio de la histidinasa, pierde el grupo α-amino para convertirse en urocanato. Luego, la urocanasa hidrata las posiciones 1 y 4 del urocanato, formándose el 4-imidazolona-5-propionato. Posteriormente ocurre la hidrólisis del grupo imino del 4-imidazolona-5-propionato, formándose el N-formiminoglutamato.
La última reacción implica la transferencia del formilo desde el N-formiminoglutamato al tetrahidrofolato, que trabaja con la enzima glutamato formimino transferasa. Los productos finales de esta reacción son el glutamato y el N5-formimino tetrahidrofolato.
El α-cetoglutarato se forma por transaminación del glutamato. El α-cetoglutarato es un intermediario del ciclo de Krebs y también puede ingresar a la ruta gluconeogénica para la formación de glucosa.
El grupo amino del glutamato entra en el ciclo de producción de urea para así ser eliminado por la orina. Todas estas reacciones ocurren en el hígado y parte de ellas en la piel.
Las necesidades diarias de histidina son de aproximadamente 10 a 11 mg por Kg de peso corporal, por día. En los niños en crecimiento, la histidina es un aminoácido esencial que debe ser suministrado con la dieta.
En otros animales, la histidina también es un aminoácido esencial y aquellos que se crían en establos deben recibir histidina para mantener sus niveles normales de hemoglobina.
Entre los alimentos ricos en histidina se encuentran:
– Las carnes de res, cordero, cerdo, pollo y pavo. Se encuentra también en pescados como el atún (incluso en el enlatado), el salmón, la trucha, el pargo y la lubina, así como también en algunos mariscos.
– La leche y sus derivados, especialmente en los quesos madurados como el parmesano, el gruyere, el queso suizo, el gouda, entre otros. En las natas, en el suero, en el yogurt y en la crema agria.
– Los granos de soja y los frutos secos como las nueces y las semillas. En las semillas de girasol, de calabaza, de sandía, de sésamo, almendras, pistacho, mantequilla de maní y chía.
– Los huevos y las alubias o frijoles blancas.
– Los cereales integrales como la quinoa, el trigo, el arroz integral, etc.
Existen una serie de condiciones patológicas en las que la histidina puede ser útil como coadyuvante para el tratamiento.
Entre estas patologías podemos nombrar la artritis reumatoide, la hipertensión arterial (ya que se ha descrito un efecto hipotensor de la histidina), en infecciones, frigidez e impotencia sexual, intoxicación por metales pesados, sinovitis tóxica, neuritis, vómitos del embarazo, trastornos cardiovasculares y de la audición, úlceras y anemias.
En la piel, la degradación de la histidina consumida produce ácido urocánico, que es capaz de proteger a la piel puesto que absorbe los rayos ultravioleta.
El consumo en exceso de histidina por individuos sanos no produce mayores alteraciones, ya que se degrada rápidamente. Sin embargo, debe restringirse el uso de suplementos dietéticos de histidina en aquellos pacientes con problemas hepáticos y/o renales severos.
El déficit de histidina está relacionado con alteraciones en la respuesta inmunológica por disminución de la producción de histamina y de glóbulos blancos, acumulación de radicales libres y malformaciones o enanismo en los fetos.
También se han reportado problemas óseos, sordera y anemias asociados al déficit de histidina.
La enfermedad de Hartnup es una afección hereditaria que afecta el transporte de histidina y de triptófano a través de la mucosa del intestino delgado y de los riñones, lo que ocasiona un déficit de ambos aminoácidos.
Las manifestaciones clínicas más relevantes son la aparición de lesiones escamosas y rojas en la piel tras la exposición al sol, diversos grados de alteración de movimiento y algunos síntomas de enfermedades psiquiátricas.
La histidinemia es una enfermedad autosómica recesiva que se caracteriza por el déficit de la enzima histidasa, lo que provoca un aumento en las concentraciones de histidina en sangre y orina.
Como consecuencia, estos pacientes no pueden degradar la histidina a ácido urocánico en el hígado y la piel. Esta enfermedad se acompaña de retraso mental moderado, defectos en el habla y en la memoria auditiva sin sordera.
La restricción de la ingesta de histidina como tratamiento no ha sido efectiva para generar mejoría clínica y conlleva el riesgo de generar trastornos en el crecimiento en los niños afectados por esta enfermedad.
- Mathews, C., van Holde, K., & Ahern, K. (2000). Biochemistry (3th ed.). San Francisco, California: Pearson.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.). doi.org
- Pencharz, P., Farri, L., & Papageorgiou, A. (1983). The effects of human milk and low-protein formulae on the rates of total body protein turnover and urinary 3-methylhistidine excretion of preterm infants. Clinical Science, 64, 611–616.
- Song, B. C., Joo, N., Aldini, G., & Yeum, K. (2014). Biological functions of histidine-dipeptides and metabolic syndrome. Nutrition Research and Practice, 8(1), 3–10.
