Bromo: historia, estructura, configuración electrónica, propiedades, usos
El bromo es un elemento no metálico que pertenece al grupo de los halógenos, grupo 17 (VIIA) de la Tabla Periódica. Su símbolo químico es el Br. Se presenta como una molécula diatómica, cuyos átomos están unidos por un enlace covalente, por lo que se le asigna la fórmula molecular Br2.
A diferencia del flúor y el cloro, el bromo en condiciones terrestres no es un gas sino un líquido marrón rojizo (imagen inferior). Es fumante, y es junto con el mercurio, los únicos elementos líquidos. Por debajo de él, el yodo, si bien se intensifica su color y se torna morado, puede cristalizar en un sólido volátil.

El bromo fue descubierto, de manera independiente, en 1825 por Carl Löwig, quien estudiaba bajo la dirección del químico alemán Leopold Gmelin; y en 1826, por el químico francés Antoine-Jérome Balard. Sin embargo, la publicación de los resultados experimentales de Balard antecedió a la de Löwig.
El bromo es el 62º elemento más abundante de la Tierra, encontrándose distribuido en bajas concentraciones por la corteza terreste. En el mar, la concentración promedio es de 65 ppm. El cuerpo humano contiene un 0,0004 % de bromo, no conociéndose en forma definitiva su función.
Este elemento se explota comercialmente en las salmueras o lugares que por condiciones especiales son sitios de alta concentración de sales; por ejemplo, el Mar Muerto, al cual confluyen las aguas de los territorios vecinos, saturadas de sales.
Es un elemento corrosivo capaz de atacar metales, como el platino y el paladio. Disuelto en agua, el bromo también puede ejercer su acción corrosiva sobre los tejidos humanos, agravándose la situación porque se puede generar el ácido bromhídrico. Respecto a su toxicidad, puede producir daños importantes en órganos, como el hígado, los riñones, el pulmón y el estómago.
El bromo es muy dañino en la atmósfera, siendo 40-100 veces más destructivo para la capa de ozono que el cloro. La mitad de la pérdida de la capa de ozono en la Antártida es producida por reacciones relacionadas con el bromometilo, compuesto utilizado como fumigante.
Tiene numerosos usos, tales como: retardador del fuego, agente blanqueador, desinfectante de superficies, aditivo para combustibles, intermediario en la fabricación de sedante, en la fabricación de productos químicos orgánicos, etc.
Índice del artículo
- 1 Historia
- 2 Estructura y configuración electrónica del bromo
- 3 Propiedades
- 3.1 Aspecto físico
- 3.2 Peso atómico
- 3.3 Número atómico
- 3.4 Olor
- 3.5 Punto de fusión
- 3.6 Punto de ebullición
- 3.7 Densidad (Br2) líquido
- 3.8 Solubilidad en agua
- 3.9 Solubilidades
- 3.10 Punto triple
- 3.11 Punto crítico
- 3.12 Calor de fusión (Br2)
- 3.13 Calor de vaporización (Br2)
- 3.14 Capacidad calórica molar (Br2)
- 3.15 Presión de vapor
- 3.16 Temperatura de auto ignición
- 3.17 Punto de ignición
- 3.18 Temperatura de almacenamiento
- 3.19 Tensión superficial
- 3.20 Umbral de olor
- 3.21 Índice de refracción (ηD)
- 3.22 Electronegatividad
- 3.23 Energía de ionización
- 3.24 Radio atómico
- 3.25 Radio covalente
- 3.26 Radio de Van der Waals
- 3.27 Reactividad
- 4 Usos
- 5 Donde se encuentra
- 6 Riesgos
- 7 Referencias
El bromo fue descubierto de forma independiente y casi simultáneamente por Carl Jacob Löwig, químico alemán en 1825, y por Antoine Balard, químico francés en 1826.
Carl Löwig, un discípulo del químico alemán Leopold Gmelin, recolectó agua de un manantial de Bad Kreuznach y le agregó cloro; después de la adición del éter, agitó la mezcla de líquidos.
Luego, separó por destilación el éter y lo concentró por evaporación. Como resultado obtuvo una sustancia marrón rojiza, que era el bromo.
Balard, por su parte, utilizó cenizas de un alga marrón conocida como fucus y las mezcló con salmuera, extraída de las salinas de Montpellier. Así liberó el bromo, haciendo pasar cloro a través del material acuoso sometido a extracción, en el cual estaba presente el bromuro de magnesio, MgBr2.
Posteriormente, el material fue destilado en presencia de dióxido de manganeso y ácido sulfúrico, produciéndose unos vapores rojos que se condensaron en un líquido oscuro. Balard pensó que era un nuevo elemento y lo llamó muride, derivado de la palabra latina muria, con la que se designaba a la salmuera.
Se ha señalado que Balard cambió el nombre de muride a brôme por sugerencia de Anglada o de Gay-Lussac, basado en que brôme significa pestilente, que define el olor del elemento descubierto.
Los resultados fueron publicados por Belard en Annales of Chemie and Physique, antes que Löwig publicara los suyos.
Solamente a partir de 1858, se logró producir bromo en cantidades importantes; año en que se descubrieron y explotaron los depósitos de sal de Stassfurt, obteniéndose bromo como un subproducto de la potasa.
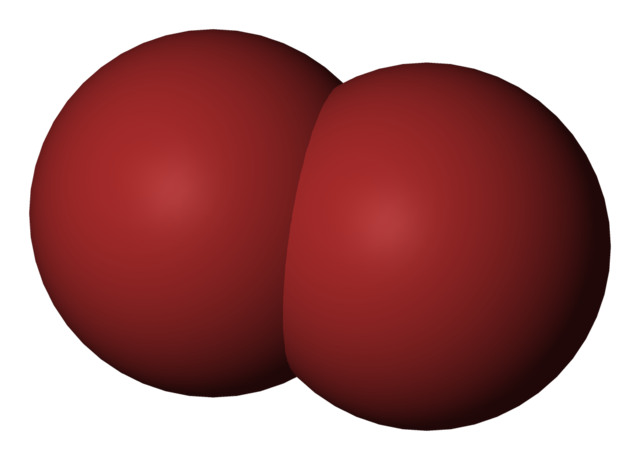
En la imagen superior se muestra la molécula de bromo, Br2, con un modelo de llenado compacto. Realmente, hay un enlace covalente simple entre los dos átomos de bromo, Br-Br.
Al ser una molécula diatómica y homogénea, carece de momento dipolar permanente y solo puede interactuar con otras del mismo tipo mediante fuerzas de dispersión de London.
Esta es la razón de por qué su líquido rojizo es fumante; en las moléculas de Br2, si bien son relativamente pesadas, sus fuerzas intermoleculares las mantienen débilmente unidas.
El bromo es menos electronegativo que el cloro, y por tanto, ejerce un efecto de atracción menor sobre los electrones de las capas de valencia. Como resultado, requiere de menos energía para transitar niveles energéticos más altos, absorbiendo fotones verdes, y reflejando un color rojizo.
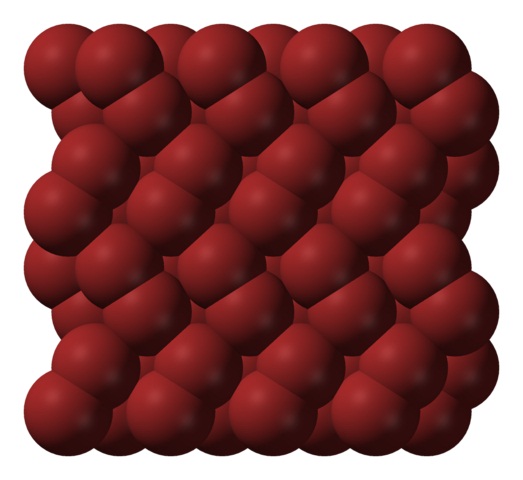
En fase gaseosa, las moléculas de Br2 se separan considerablemente hasta no haber interacciones eficientes entre ellas. Sin embargo, por debajo de su punto de fusión, el bromo puede congelarse en cristales ortorrómbicos rojizos (imagen superior).
Nótese cómo las moléculas de Br2 se posicionan ordenadamente de tal modo que parecen “gusanos de bromo”. Aquí y a estas temperaturas (T -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
La configuración electrónica del bromo es:
[Ar]3d104s2 4p5
Siendo 3d104s2 4p5 su capa de valencia (aunque el orbital 3d10 no tenga protagonismo en sus reacciones químicas). Los electrones de los orbitales 4s y 4p son los más externos y suman un total de 7, a solo un electrón de completar el octeto de valencia.
De esta configuración pueden deducirse los estados de oxidación posibles para el bromo: -1, si gana un electrón para ser isoelectrónico al kriptón; +1, quedando como 3d104s2 4p4; +3, +4 y +5, perdiendo todos los electrones del orbital 4p ([Ar]3d104s24p0); y +7, quedando sin electrones en el orbital 4s ([Ar]3d104s04p0).
Líquido fumante de color oscuro marrón rojizo. Se encuentra en la naturaleza como una molécula diatómica, con los átomos unidos por un enlace covalente. El bromo es un líquido más denso que el agua y se hunde en ella.
79,904 g/mol.
35.
Un humo acre, sofocante e irritante.
-7,2 ºC.
58,8 ºC.
3,1028 g/cm3
33,6 g/L a 25°C. La solubilidad del bromo en agua es baja y tiende a aumentar al disminuir la temperatura; comportamiento parecido al de otros gases.
Libremente soluble en alcohol, éter, cloroformo, tetracloruro de carbono, disulfuro de carbono, y ácido clorhídrico concentrado. Soluble en solventes no polares y algunos polares como alcohol, ácido sulfúrico y en muchos solventes halogenados.
265,9 K a 5,8 kPa.
588 K a 10,34 MPa.
10,571 kJ/mol.
29,96 kJ/mol.
75,69 kJ/mol.
A una temperatura de 270 K, 10 kPa.
No inflamable.
113 ºC.
De 2 a 8 ºC.
40,9 mN/m a 25 ºC.
0,05 – 3,5 ppm. 0,39 mg/m3
1,6083 a 20 ºC, y 1,6478 a 25 ºC.
2,96 en la escala de Pauling.
– Primer nivel: 1.139,9 kJ/mol.
– Segundo nivel: 2.103 kJ/mol.
– Tercer nivel: 3.470 kJ/mol.
120 pm.
120,3 pm.
185 pm.
Es menos reactivo que el cloro, pero más reactivo que el yodo. Es un oxidante menos fuerte que el cloro y más fuerte que el yodo. Asimismo, es un agente reductor más débil que el yodo, pero más fuerte que el cloro.
El vapor del cloro es altamente corrosivo para muchos materiales y a los tejidos humanos. Ataca a muchos elementos metálicos, incluyendo el platino y el paladio; pero no ataca al plomo, níquel, magnesio, hierro, cinc, y bajo 300 ºC tampoco al sodio.
El bromo en el agua experimenta un cambio y se transforma en bromuro. También puede existir como bromato (BrO3–), dependiendo del pH del líquido.
Debido a su acción oxidante, el bromo puede inducir la liberación de radicales libres de oxígeno. Estos son oxidantes fuertes y pueden producir daño tisular. También, el bromo puede producir una ignición espontánea cuando se combina con el potasio, el fósforo o el estaño.
El dibromuro de etileno se usó para eliminar los posibles depósitos de plomo en los motores de los automóviles. Después de la combustión de la gasolina, que usaba plomo como aditivo, el bromo se combinaba con el plomo para formar bromuro de plomo, un gas volátil que era expulsado por el tubo de escape.
Si bien el bromo eliminaba el plomo de la gasolina, su acción destructiva sobre la capa de ozono era muy poderosa, motivo por el que se desechó para esta aplicación.
El bromuro de metileno o bromometilo se usó como pesticida para purificar suelos, especialmente para eliminar los nemátodos parásitos, como el anquilostomo.
No obstante, se ha desechado el uso de la mayor parte de los compuestos que contienen bromo por su acción, nuevamente, destructiva sobre la capa de ozono.
El bromo es utilizado en algunas plantas para reducir la emisión de mercurio, metal muy tóxico.
El bromuro de plata, además del yoduro de plata y el cloruro de plata, se usa como un compuesto sensible a la luz en las emulsiones fotográficas.
El bromuro de potasio, así como el bromuro de litio, se utilizaron como sedantes generales en el siglo XIX y principio del siglo XX. Los bromuros en forma de sales simples, todavía se usan en algunos países como anticonvulsivos.
Sin embargo, la FDA de los Estados Unidos no aprueba el empleo del bromo para el tratamiento de ninguna enfermedad hoy en día.
El bromo es transformado por las llamas en ácido bromhídrico, el cual interfiere con la reacción de oxidación que ocurre durante el fuego, y produce su extinción. Se emplean polímeros que contienen bromo para elaborar resinas retardadoras del fuego.
Se han agregado trazas de bromato de potasio a la harina para mejorar su cocción.
El bromuro de hidrógeno se utiliza como agente reductor y catalizador de reacciones orgánicas. El bromo se utiliza como intermediario químico en la fabricación de fármacos, fluidos hidráulicos, agentes refrigerantes, deshumidificadores, y en preparaciones para ondular el cabello.
Igualmente encuentra uso en la elaboración de fluidos de perforación de pozos, de productos para la desinfección de agua, de agentes blanqueadores, de desinfectantes de superficies, de colorantes, de aditivos para combustibles, etc.
Un estudio realizado en 2014 señala que el bromo es un cofactor necesario para la biosíntesis del colágeno IV, lo cual hace del bromo un elemento esencial para el desarrollo tisular animal. Sin embargo, no hay información acerca de las consecuencias de un déficit del elemento.
El bromo es extraído comercialmente de las minas de sal y pozos de salmueras profundos que se encuentran en el estado de Arkansas, y en el Gran Lago Salado de Utah, ambos en Estados Unidos. Esta última salmuera tiene una concentración de bromo de 0,5 %.
Para extraer el bromo, se agrega el cloro en estado gaseoso en caliente a la salmuera, para oxidar los iones bromuro de la solución, recogiéndose el bromo elemental.
El Mar Muerto, en la frontera entre Jordania e Israel, es un mar cerrado que se encuentra bajo el nivel de mar, lo que hace que tenga una altísima concentración de sales.
El bromo y la potasa son obtenidos allí comercialmente, mediante la evaporación del agua con alto contenido de sal del Mar Muerto. En este mar la concentración de bromo, puede alcanzar los 5 g/L.
También se encuentra en altas concentraciones en algunos manantiales de aguas termales. La brominita, por ejemplo, es un mineral de bromuro de plata encontrado en Bolivia y México.
El bromo en estado líquido es corrosivo para los tejidos humanos. Pero el mayor peligro para el hombre proviene de los vapores de bromo y de su inhalación.
Respirar en un ambiente con una concentración de bromo de 11–23 mg/m3 produce shocks severos. Una concentración de 30–60 mg/m3 es extremadamente dañina. Mientras, una concentración de 200 mg puede ser fatal.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- National Center for Biotechnology Information. (2019). Bromine. PubChem Database. CID=23968. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (08 de febrero de 2017). Facts about bromine. Recuperado de: livesscience.com
- Wikipedia. (2019). Borax. Recuperado de: en.wikipedia.org
- Lenntech B. V. (2019). Bromine. Recuperado de: lenntech.com
