Bisulfito de sodio (NaHSO3): estructura, propiedades, usos, obtención
El bisulfito de sodio es un sólido inorgánico formado por un ion sodio Na+ y un ion bisulfito HSO3–. Su fórmula química es NaHSO3. Es un sólido blanco cristalino y por sus propiedades antioxidantes se usa ampliamente como conservante de alimentos (por ejemplo en algunas mermeladas).
El NaHSO3 es un compuesto químico reductor, que es lo contrario de oxidante, y por esta razón actúa como antioxidante en muchas de sus aplicaciones, como por ejemplo en productos comestibles, pues impide su deterioro.

Sin embargo este uso ha sido cuestionado pues se han reportado casos de asma en personas después que han comido alimentos que contienen bisulfito de sodio. Incluso se dice que destruye la vitamina B1 de estos.
Las organizaciones internacionales de salud han restringido su uso a microcantidades en los alimentos.
Sin embargo, el bisulfito de sodio tiene muchos otros usos, como por ejemplo en la obtención de yodo, como antiinfeccioso, para blanquear tejidos, para la digestión de la madera durante la preparación de pulpa de papel, como desinfectante de toneles de cerveza y vino, etc.
Índice del artículo
El bisulfito de sodio está formado por un catión sodio Na+ y un anión bisulfito HSO3–.

En las soluciones acuosas el bisulfito forma 4 especies. En solución diluida hay un equilibrio entre las estructuras que se muestran a continuación:
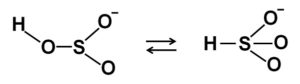
Cuando aumenta la concentración dos moléculas de bisulfito interaccionan entre sí formando el ión pirosulfito S2O52-:

-Bisulfito de sodio
-Hidrogenosulfito de sodio
-Hidrosulfito de sodio.
Sólido blanco cristalino.
104,06 g/mol
Se descompone.
1,48 g/cm3 a 20 ºC.
Soluble en agua: 29 g/100 g de agua.
Sus soluciones son ácidas, con un pH entre 2,5 y 5,5.
En solución acuosa el bisulfito de sodio NaHSO3 se separa en sus iones: el catión sodio Na+ y el anión bisulfito HSO3–.
Si el bisulfito de sodio se expone al aire pierde algo de SO2 y se oxida lentamente a sulfato Na2SO4.
Si se calienta hasta su descomposición emite humos de óxidos de azufre y monóxido de sodio.
Es un agente reductor, que es lo contrario de oxidante. Y por esta razón se puede comportar como antioxidante.
Posee un ligero olor a azufre. No es inflamable.
El bisulfito de sodio NaHSO3 es un fuerte irritante de piel y tejidos. El polvo irrita los ojos, nariz y garganta. Por ingestión irrita el estómago. Dosis grandes pueden causar cólicos violentos, diarrea, depresión y muerte.
No es combustible pero si se calienta produce gases irritantes y tóxicos.
Se prepara saturando una solución de carbonato de sodio Na2CO3 con dióxido de azufre SO2 y se cristaliza en la solución.
El NaHSO3 se emplea en la digestión de la madera, para que esta pueda luego convertirse en papel. Sirve además como blanqueador de la pulpa.
También se utiliza para eliminar el cloro cuando se ha blanqueado la pulpa de papel con este.
El bisulfito de sodio por su propiedad reductora actúa como antioxidante.
Se utiliza como conservante en una gran cantidad de alimentos y bebidas, incluyendo vino y cerveza, para prevenir su deterioro y mejorar el sabor.
Sirve para blanquear alimentos, como por ejemplo ciertos almidones comestibles.
Reduce o previene el deterioro de los alimentos, permite acondicionar la masa utilizada en alimentos horneados y sirve para ablandar los granos de maíz durante la molienda húmeda, entre otros usos.
Además de controlar la fermentación del vino y la cerveza, actúa como antiséptico en su elaboración pues sirve como esterilizante y fungicida en barricas y tinas.

En frutas desecadas se encuentra en concentraciones por encima de 100 ppm (ppm significa “partes por millón”), en muchos otros alimentos se encuentra en concentraciones entre 10 y 100 ppm, como papas congeladas y secas, encurtidos, salsas y mermeladas.

Ha habido cierta preocupación acerca de los efectos tóxicos tanto inmediatos como a largo plazo del bisulfito de sodio en los alimentos. Hay opiniones divergentes.
Hay reportes de reacciones adversas de pacientes con asma, que es una enfermedad respiratoria, luego de la ingestión de comestibles con NaHSO3. Otras fuentes indican que el ion bisulfito puede destruir la vitamina B1 o tiamina.

Sin embargo, ciertos investigadores en 1985 encontraron que el bisulfito de sodio sirve para proteger contra las radiaciones y contra agentes químicos, e inhibe o impide la transformación de las células hacia el cáncer. Las dosis bajas son las mejores.
Se ha explicado este efecto protector basándose en sus propiedades reductoras o antioxidantes y que de esta forma podría atacar los radicales libres.
Por otra parte, la Organización Mundial para la Salud, o WHO (por sus siglas del inglés World Health Organization), recomienda como nivel aceptable de ingesta diaria unos 0,7 mg/Kg de peso de la persona.
Eso significa que se recomienda no excederse de esa cantidad.
La Administración de Alimentos y Medicinas de los Estados Unidos, o USFDA (siglas del inglés US Food and Drug Administration), clasificó al bisulfito de sodio como “generalmente reconocido como seguro”.
Utilizado a bajas concentraciones el NaHSO3 sirve como regulador de crecimiento de las plantas, para mejorar la fotosíntesis y promover el rendimiento del cultivo.
Se ha probado con este objetivo en varios tipos de plantas como por ejemplo en plantas de fresas y de té.

Es el ingrediente activo de muchos pesticidas y biocidas.
En ambientes acuáticos también puede acelerar la transformación de ciertos herbicidas a productos menos tóxicos mediante la eliminación del cloro.
El NaHSO3 es el compuesto reductor empleado para liberar yodo del yodato de sodio NaIO3. Esta es una de las formas de obtener yodo de fuentes como el nitro de Chile o algunas aguas salinas.
Luego de cristalizar el nitrato sódico de la solución de nitrato de Chile bruto, queda una solución de NaIO3 que se trata con bisulfito de sodio NaHSO3, generando yodo libre.
2 NaIO3 + 5 NaHSO3 → 3 NaHSO4 + Na2SO4 + I2
El NaHSO3 se ha probado para modificar proteínas de soya y mejorar sus propiedades de adhesión con la madera con el objetivo de pegar trozos de madera entre sí para preparar por ejemplo aglomerados, cartón madera o cartón piedra, contraenchapado, etc. Todo ello para muebles o tableros, entre varias aplicaciones.

Esto se hace para sustituir a los tradicionales adhesivos basados en formaldehído porque tanto en su proceso de fabricación como durante su uso tienden a liberar formaldehido a la atmósfera, el cual es un compuesto tóxico.
El bisulfito de sodio mejora el contenido de sólidos del adhesivo de proteínas de soya, y disminuye la viscosidad de este mejorando su fluidez por lo que penetra mejor en los poros de la madera, aumentando su cohesión con esta y entre las piezas.
El adhesivo de proteínas de soya modificadas con NaHSO3 presenta una buena resistencia al agua y excelente estabilidad al almacenaje debido a la acción antioxidante del bisulfito de sodio.
Esto confirma que los adhesivos de proteínas de soya modificadas con NaHSO3 son comparables a los adhesivos basados en formaldehido y pueden ser utilizados en la industria de muebles y madera, siendo menos contaminantes.
Tiene múltiple usos, basados generalmente en sus propiedades reductoras (que es lo contrario de oxidante). A continuación algunas aplicaciones.
-En fotografía.
-En el curtido de cuero, para quitar el pelo a las pieles.
-Usos terapéuticos: antiinfeccioso. Se usa como antioxidante en algunas gotas para los -ojos.
-En la extracción de gas natural mediante fractura hidráulica.
-En la coloración de fibras se usa para la preparación de baños de tina calientes o fríos, para solubilizar ciertos tintes o colorantes.
-Como reductor en lavandería o blanqueo, para blanquear lana, seda y fibras vegetales.
-En laboratorios de química para eliminar manchas de permanganato de la piel y ropa. En laboratorios de bioquímica como conservante de líquidos o soluciones que se pueden deteriorar con el tiempo. Como reactivo químico.
-Para la coagulación de látex de goma.
-En la industria cosmética como antioxidante.
-Desinfectante y blanqueador.
-En el tratamiento de aguas residuales para eliminar el cloro utilizado en la etapa final de desinfección y poder descargar las aguas ya tratadas al ambiente.

- U.S. National Library of Medicine. (2019). Sodium bisulfite. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Qi, G. et al. (2013). Adhesion and Physicochemical Properties of Soy Protein Modified by Sodium Bisulfite. J Am Oil Chem Soc (2013) 90:1917-1926. Recuperado de aocs.onlinelibrary.wiley.com.
- Borek, C. et al. (1985). Sodium bisulfite protects against radiogenic and chemically induced transformation in hamster embryo and mouse C3H/10T-1/2 cells. Toxicol Ind Health 1985Sep; 1(1):69-74. Recuperado de journals.sagepub.com.
- Friedler, E. et al. (2015). A continuous active monitoring approach to identify cross-connections between potable water and effluent distribution systems. Environ Monit Assess (2015) 187:131. Recuperado de link.springer.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Sunnyvale Cleanwater Program. (2019). Water Pollution Control Plant Master Plan. Recuperado de sunnyvalecleanwater.com.
- Barros Santos, C. (2008). Los aditivos en la alimentación de los españoles y la legislación que regula su autorización y uso. Visión Libros. Recuperado de books.google.co.ve.
