Gases: propiedades, comportamiento, forma, ejemplos
Los gases son todas aquellas sustancias o compuestos cuyos estados de agregación son débiles y dispersos, a la vez que dependen enormemente de las condiciones de presión y temperatura que gobiernan sobre ellos. Constituyen quizás la segunda forma de materia más abundante de todo el Universo después del plasma.
En la Tierra los gases componen las capas de la atmósfera, desde la exósfera, hasta la tropósfera y el aire que respiramos. Aunque un gas es invisible cuando se halla difundido por grandes espacios, como por ejemplo el cielo, se le detecta por el movimiento de las nubes, los giros de las aspas de un molino, o por los vapores exhalados de nuestras bocas en climas fríos.

Asimismo, yendo a los aspectos negativos ambientales, se le observa en el humo negro del tubo de escape de los vehículos, en las columnas de humo de las torres ubicadas en las fábricas, o en las humaredas levantadas cuando arde un bosque.
También se está frente a fenómenos gaseosos cuando se ven vapores que salen de las alcantarillas, en los fuegos fatuos de los pantanos y cementerios, en el burbujeo dentro de las peceras, en los ramos de globos de helio que se sueltan al cielo, en el oxígeno que liberan las plantas producto de su fotosíntesis, y hasta en los eructos y flatulencias.
Donde quiera que se observen los gases significa que hubo una reacción química, a menos que se fijen o asimilen directamente del aire, principal fuente de gases (superficialmente) del planeta. A medida que las temperaturas aumentan, toda sustancia (elementos químicos) se transformarán en gases, incluyendo los metales como el hierro, el oro y la plata.
Sin importar la naturaleza química de los gases, todos comparten en común la gran distancia que separa sus partículas (átomos, moléculas, iones, etc.), las cuales se mueven caótica y arbitrariamente por un volumen o espacio determinados.
Índice del artículo
- 1 Propiedades de los gases
- 2 Comportamiento de los gases
- 3 Forma de los gases
- 4 Presión de un gas
- 5 Volumen de un gas
- 6 Principales leyes de los gases
- 7 Tipos de gases
- 8 Ejemplos de elementos y compuestos gaseosos
- 9 Referencias
Las propiedades físicas de los gases varían dependiendo de qué sustancia o compuesto se trata. Popularmente los gases se hallan asociados a malos olores o putrefacción, a causa bien de su contenido en azufre, o a la presencia de aminas volátiles. Asimismo, se visualizan de coloraciones verdosas, pardas o amarillentas, las cuales intimidan y dan mal presagio.
No obstante, la mayoría de los gases, o por lo menos los más abundantes, son en realidad incoloros e inodoros. Aunque sean inasibles, se les puede sentir en la piel y oponen resistencia al movimiento, creando inclusive capas viscosas en los cuerpos que los atraviesan (como sucede con los aviones).
Todos los gases pueden experimentar cambios de presión o temperatura que los terminan convirtiendo en sus respectivos líquidos; es decir, sufren condensación (si se les enfría) o licuefacción (si se les “presiona”).

Por otro lado, los gases son capaces de disolverse en líquidos y algunos sólidos porosos (como el carbón activado). Las burbujas son el resultado de cúmulos de gases que todavía no se han disuelto en el medio y escapan hacia la superficie del líquido.
En condiciones normales (sin ionización de sus partículas), los gases son malos conductores del calor y la electricidad. No obstante, cuando se les tensa con muchos electrones permiten el paso de la corriente a través de ellos, tal como se aprecia en los rayos durante las tempestades.
Por otro lado, a bajas presiones y sometidos a un campo eléctrico, algunos gases, en especial los nobles o perfectos, se iluminan y sus luces se aprovechan para el diseño de anuncios y carteles nocturnos (luz de neón), así como en las famosas lámparas de descargas eléctricas en los faroles de las calles.
Respecto a la conductividad térmica, muchos gases se comportan como aislantes térmicos, por lo que su incorporación en el relleno de fibras, tejidos, o paneles de vidrio, ayuda a evitar que el calor los traspase y mantiene constante la temperatura.
Sin embargo, hay gases que son buenos conductores del calor, y pueden provocar quemaduras peores que las ocasionadas por los líquidos o sólidos; por ejemplo, como sucede con el vapor caliente de los pastelitos horneados (o empanadas), o con los chorros de vapor que escapan de las calderas.
Generalmente las reacciones que involucran gases, o donde se producen estos, se califican de peligrosas y engorrosas.
Su reactividad depende, nuevamente, de la naturaleza química de los mismos; sin embargo, al expandirse y movilizarse con gran facilidad, se debe tener mayor cuidado y control porque pueden desencadenar aumentos drásticos de la presión que ponen en riesgo la estructura del reactor; esto sin mencionar qué tan inflamables o no son dichosos gases.
Macroscópicamente uno puede darse una idea del comportamiento de los gases al presenciar cómo el humo, los anillos, o las “lenguas” literarias de los cigarrillos evolucionan en el aire. Asimismo, al explotar una granada de humo resulta interesante detallar el movimiento de esas nubecillas de distintos colores.

No obstante, tales observaciones están sujetas a la acción del aire, y también al hecho de que hay finísimas partículas sólidas suspendidas en el humo. Por lo tanto, no bastan estos ejemplos para llegar a una conclusión respecto al verdadero comportamiento de un gas. En lugar de ello, se han realizado experimentos y desarrollado la teoría cinética de los gases.
Molecular e idealmente, las partículas gaseosas colisionan elásticamente unas con otras, teniendo desplazamientos lineales, rotacionales y vibracionales. Poseen una energía promedio asociada, la cual le permite viajar libremente por cualquier espacio sin casi interaccionar o chocar con otra partícula a medida que aumenta el volumen alrededor de ellas.
Su comportamiento vendría a ser una mezcla del movimiento errático browniano, y el de unas colisiones de unas bolas de billar que rebotan sin cesar entre sí y las paredes de la mesa; si no hay paredes, se difundirán hacia el infinito, a menos que una fuerza las retengan: la gravedad.
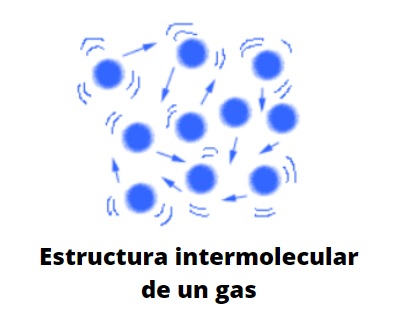
Los gases, a diferencia de los líquidos y sólidos, no son materia del tipo condensada; es decir, la agregación o cohesión de sus partículas nunca logran definir una forma. Comparten con los líquidos el hecho de que ocupan completamente el volumen del recipiente que los contienen; sin embargo, carecen de superficie y tensión superficial.
Si la concentración del gas es alta, podrá visualizarse a simple vista sus “lenguas” o las formas macroscópicas ya descritas. Estas, tarde o temprano, terminarán desvaneciéndose por acción del viento o por la mera expansión del gas. Los gases por lo tanto recubren todos los rincones del espacio limitado originando sistemas altamente homogéneos.
Ahora bien, la teoría considera convenientemente a los gases como esferas que apenas colisionan consigo mismas; pero cuando lo hacen, rebotan elásticamente.
Estas esferas están muy separadas unas de otras, por lo que los gases prácticamente están “llenos” de vacío; de allí se debe su versatilidad por atravesar la más mínima rendija o fisura, y la facilidad de poder comprimirlos notablemente.
Es por eso que por más cerrada que sea la instalación de una panadería, si se camina por al lado es seguro que se disfrutará del aroma de los panes recién horneados.
Se pudiera creer que por estar tan dispersas y separadas las esferas o partículas del gas, estas sean incapaces de generar presión alguna sobre los cuerpos u objetos. Sin embargo, la atmósfera demuestra que tal creencia es falsa: tiene masa, pesa y evita que los líquidos se evaporen o hiervan de la nada. Los puntos de ebullición se miden a la presión atmosférica.
Las presiones de los gases se vuelven más cuantificables si se disponen de manómetros, o si están encerrados de recipientes de paredes no deformables. Así, mientras más partículas de gas haya dentro del recipiente, mayor será el número de colisiones entre ellas y las paredes del mismo.
Estas partículas al colisionar contra las paredes las presionan, pues ejercen sobre su superficie una fuerza proporcional a su energía cinética. Es como si se aventaran las ideales bolas de billar a una pared; si son muchas las que las impactan a gran velocidad, podría llegar hasta romperse.
Existen muchas unidades que acompañan las mediciones de la presión de un gas. Unas de las más conocidas son los milímetros de mercurios (mmHg), al igual que los torr. Están las del sistema internacional de unidades (SI) que definen el pascal (Pa) en términos de N/m2; y de él, el kilo (kPa), mega (MPa) y giga (GPa) pascal.
Un gas ocupa y se expande por todo el volumen del recipiente. Mientras más grande sea el recipiente, el volumen del gas también lo será; pero tanto su presión como densidad disminuirán para una misma cantidad de partículas.
El gas en sí mismo, por otra parte, sí tiene un volumen asociado que no depende tanto de su naturaleza o estructura molecular (idealmente), sino de las condiciones de presión y temperatura que gobiernan sobre él; este es, su volumen molar.
En la realidad, el volumen molar varía de un gas a otro, aunque las variaciones son pequeñas si no se tratan de moléculas heterogéneas y grandes. Por ejemplo, el volumen molar del amoníaco (NH3, 22,079 L/mol) a 0 ºC y 1 atm, se diferencia del de helio (He, 22,435 L/mol).
Todos los gases tienen un volumen molar que cambia en función de P y T, y sin importar cuán grandes sean sus partículas, el número de ellas es el mismo siempre. De aquí de hecho derivó lo que se conoce por el número de Avogadro (NA).
El comportamiento de los gases se ha venido estudiando desde siglos pasados mediante la realización de experimentos, profundas observaciones e interpretación de los resultados.
Tales experimentos permitieron sentar una serie de leyes que, reunidas en una misma ecuación (la de los gases ideales), ayudan a predecir las respuestas de un gas a distintas condiciones de presión y temperatura. De esta manera, se tiene una relación entre su volumen, temperatura y presión, así como del número de sus moles en un determinado sistema.
Entre estas leyes se tienen a las siguientes cuatro: Boyle, Charles, Gay-Lussac y la de Avogadro.
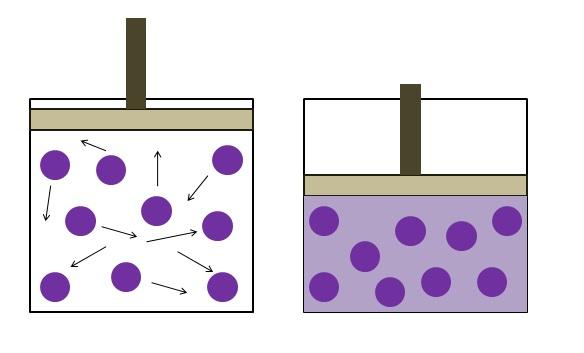
La ley de Boyle establece que a temperatura constante, el volumen de un gas ideal es inversamente proporcional a su presión; esto es, mientras más grande sea el recipiente, menor será la presión que experimentarán sus paredes por una misma cantidad de gas.

La ley de Charles establece que a presión constante, el volumen de un gas ideal es directamente proporcional a su temperatura. Los globos demuestran la ley de Charles, porque si se les calientan se inflan un poco más, mientras que si se sumergen en nitrógeno líquido, se desinflan porque el volumen del gas en su interior se contrae.
La ley de Gay-Lussac establece que a volumen constante, la presión de un gas ideal es directamente proporcional a su temperatura. En un caldero bien cerrado si se calienta un gas progresivamente, cada vez la presión en su interior será mayor, porque las paredes del caldero no se deforman ni dilatan; es decir, su volumen no cambia, es constante.
Finalmente, la ley de Avogadro establece que el volumen ocupado por un gas ideal es directamente proporcional al número de sus partículas. Es así pues, que si se tiene un mol de partículas (6,02·1023), se tendrá entonces el volumen molar del gas.
Son aquellos gases cuyos componentes funcionan como combustibles, por que son utilizados para la producción de energía térmica. Algunos de ellos son el gas natural, el gas licuado de petróleo y el hidrógeno.
Son aquellos gases manufacturados, que se comercializan al público para distintos usos y aplicaciones, como por ejemplo para los sectores de la salud, la comida, protección ambiental, metalurgia, industria química, seguridad, entre otros. Algunos de estos gases son el oxígeno, nitrógeno, helio, cloro, hidrógeno, monóxido de carbono, propano, metano, óxido nitroso, entre otros.
Son aquellos gases que bajo condiciones de temperatura y presión específicas, no generan ninguna reacción química o una muy baja. Son el neón, argón, helio, kriptón y el xenón. Se utilizan en procesos químicos en los que son necesarios elementos no reactivos.
¿Cuáles son los elementos gaseosos de la tabla periódica en condiciones terrestres?
Tenemos primero al hidrógeno (H), el cual forma moléculas H2. Le sigue el helio (He), el gas noble más liviano; y luego el nitrógeno (N), oxígeno (O) y flúor (F). Estos últimos tres también forman moléculas diatómicas: N2, O2 y F2.
Después del flúor viene el neón (Ne), el gas noble que le sigue al helio. Debajo del flúor tenemos al cloro (Cl), en forma de moléculas Cl2.
A continuación tenemos al resto de los gases nobles: argón (Ar), kriptón (Kr), xenón (Xe), radón (Rn) y oganesón (Og).
Por lo tanto, son un total de doce elementos gaseosos; once si excluimos al altamente radiactivo e inestable oganesón.
Además de elementos gaseosos, se enlistarán algunos compuestos gaseosos comunes:
-H2S, sulfuro de hidrógeno, responsable del olor a huevos podridos
-NH3, amoníaco, ese aroma penetrante que se percibe en jabones usados
-CO2, dióxido de carbono, un gas invernadero
-NO2, dióxido de nitrógeno
-NO, monóxido de nitrógeno, un gas que se creía sumamente tóxico pero que juega un papel importante en el sistema circulatorio
-SO3, trióxido de azufre
-C4H10, butano
-HCl, cloruro de hidrógeno
-O3, ozono
-SF6, hexafluoruro de azufre
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- The Properties of Gases. Recuperado de: chemed.chem.purdue.edu
- Wikipedia. (2019). Gas. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (05 de diciembre de 2018). Gases – General Properties of Gases. Recuperado de: thoughtco.com
- Harvard Men’s Health Watch. (2019). The state of gas. Recuperado de: health.harvard.edu
- Electronics Cooling Editors. (01 de septiembre de 1998). The thermal conductivity of gases. Recuperado de: electronics-cooling.com
