Ley de Charles: fórmulas y unidades, experimento, ejercicios
La ley de Charles o de Guy-Lussac es aquella que permite el enunciado de una de las propiedades del estado gaseoso: el volumen que ocupa un gas es directamente proporcional a la temperatura a presión constante.
Esta proporcionalidad es lineal para todos los rangos de temperaturas si el gas en cuestión es ideal; los gases reales, por otra parte, se desvían de la tendencia lineal a temperaturas cercanas a su punto de condensación. Sin embargo, esto no ha limitado el uso de esta ley para un sinfín de aplicaciones donde participan los gases.

Una de las aplicaciones por excelencia de la ley de Charles se presencia en los globos aerodinámicos. Otros globos más simples, como los de los deseos, también llamados farolillos chinos (imagen superior), ponen en manifiesto la relación entre el volumen y la temperatura de un gas a presión constante.
¿Por qué a presión constante? Porque si la presión aumentara, significaría que el contenedor donde se encuentra el gas está cerrado herméticamente; y con ello, aumentarían las colisiones o impactos de las partículas gaseosas contra las paredes internas de dicho contenedor (ley de Boyle-Mariotte).
Por lo tanto, no habría un cambio del volumen ocupado por el gas, y la ley de Charles no tendría rigor. Al contrario de un recipiente hermético, el tejido de los globos de los deseos representa una barrera móvil, capaz de dilatarse o contraerse dependiendo de la presión que ejerce el gas en su interior.
Sin embargo, al expandirse el tejido de los globos, la presión interna del gas permanece constante porque aumenta el área sobre la cual colisionan sus partículas. Mientras mayor sea la temperatura del gas, mayor será la energía cinética de las partículas, y por tanto, el número de colisiones.
Y al expandirse nuevament el globo, las colisiones contra sus paredes internas permanecen (idealmente) constantes.
Entonces, mientras más caliente esté el gas, mayor será la expansión del globo y más ascenderá. El resultado: luces rojizas (aunque peligrosas) suspendidas en el cielo durante las noches decembrinas.
Índice del artículo
- 1 ¿En qué consiste la ley de Charles?
- 2 Fórmulas y unidades de medición
- 3 Experimento para demostrar la ley
- 4 Ejercicios resueltos
- 5 Aplicaciones
- 6 Referencias
La llamada Ley de Charles o Ley de Gay-Lussac explica la dependencia que existe entre el volumen ocupado por un gas y el valor de su temperatura absoluta o temperatura Kelvin.
La Ley puede ser enunciada en la forma siguiente: si la presión permanece constante, se cumple que “para una masa dada de un gas, este aumenta su volumen en 1/273 veces aproximadamente de su volumen a 0 ºC, por cada grado centígrado (1 ºC) que aumente su temperatura”.
Los trabajos de investigación que permitieron establecer la ley fueron iniciados en la década de 1780 por Jacques Alexander Cesar Charles (1746-1823). Sin embargo, Charles no publicó los resultados de sus investigaciones.
Posteriormente, John Dalton en 1801 logró determinar experimentalmente que todos los gases y los vapores, estudiados por él, se expanden entre dos temperaturas determinadas en una misma cantidad de volumen. Estos resultados fueron confirmados por Gay-Lussac en el año de 1802.
Los trabajos de investigación de Charles, Dalton y Gay-Lussac, permitieron establecer que el volumen ocupado por un gas y su temperatura absoluta son directamente proporcionales. Por lo tanto, existe una relación lineal entre la temperatura y el volumen de un gas.
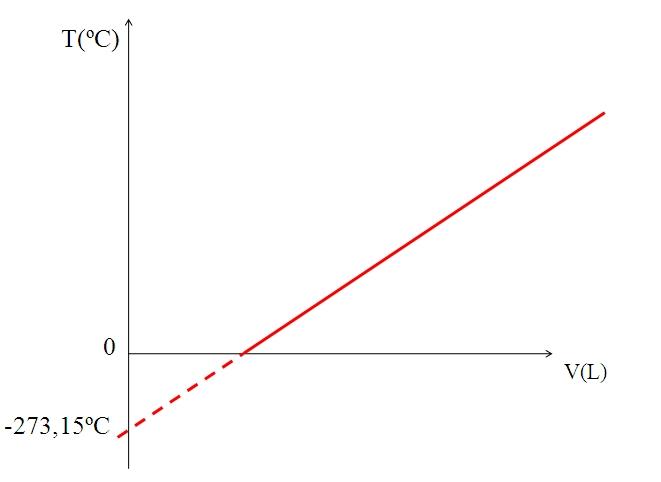
La realización de un gráfico (imagen superior) del volumen de un gas contra la temperatura produce una línea recta. La intersección de la recta con el eje de la X, a la temperatura de 0 ºC, permite obtener el volumen del gas a 0 ºC.
Asimismo, la intersección de la recta con el eje de la X, daría información acerca de la temperatura para la cual el volumen ocupado por el gas sería cero “0”. Dalton estimó este valor en -266 ºC, cercano al valor sugerido por Kelvin para el cero (0) absoluto.
Kelvin propuso una escala de temperatura cuyo cero, debería ser la temperatura a la cual un gas perfecto tendría un volumen de cero. Pero a estas bajas temperaturas los gases están licuados.
Es por eso que no puede hablarse de volúmenes de gases como tales, Encontrándose que el valor para el cero absoluto debería ser -273,15 ºC.
La ley de Charles en su versión moderna señala que el volumen y la temperatura de un gas son directamente proporcionales.
Entonces:
V / T = k
V = volumen de gas. T = temperatura Kelvin (K). k = constante de proporcionalidad.
Para un volumen V1 y una temperatura T1
k = V1 / T1
Asimismo, para un volumen V2 y una temperatura T2
k = V2 / T2
Luego, igualando las dos ecuaciones para k se tiene
V1 / T1 = V2 / T2
Esta fórmula puede escribirse de la forma siguiente:
V1 · T2 = V2 · T1
Despejando V2, se obtiene la fórmula:
V2 = V1 · T2 / T1
El volumen del gas puede expresarse en litros o en cualquiera de sus unidades derivadas. Asimismo, el volumen puede expresarse en metros cúbicos o en cualquiera unidad derivada. La temperatura debe expresarse en temperatura absoluta o temperatura Kelvin.
Entonces, si las temperaturas de un gas están expresadas en grados centígrados o escala Celsius, para realizar un cálculo con ellas habría que sumarle a las temperaturas la cantidad de 273,15 ºC, para así llevarlas a temperaturas absolutas o kelvin.
Si las temperaturas están expresadas en grados Farenheit, habría que sumarles a esas temperaturas 459,67 ºR, para llevarlas a temperaturas absolutas en la escala de Rankine.
Otra fórmula conocida de la Ley de Charles, y directamente relacionada con su enunciado, es la siguiente:
Vt = Vo (1 + t/273)
Donde Vt es el volumen ocupado por un gas a una determinada temperatura, expresado en litros, cm3, etc.; y Vo es el volumen ocupado por un gas a 0 ºC. Por su parte, t es la temperatura en la cual se hace la medición del volumen, expresada en grados centígrados (ºC).
Y finalmente, 273 representa el valor del cero absoluto en la escala de temperatura de Kelvin.
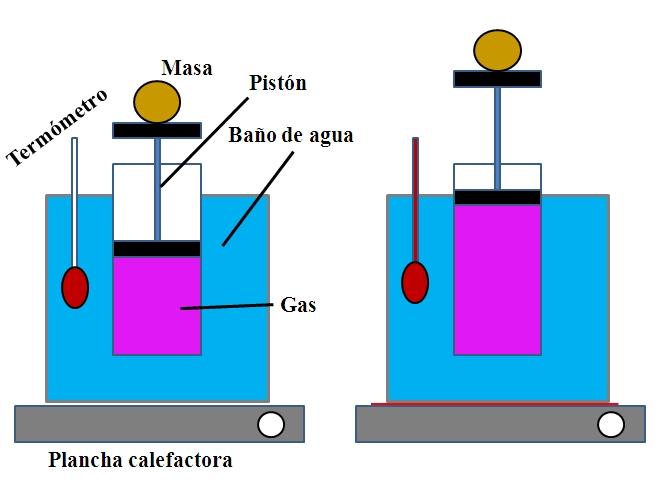
En un recipiente de agua, que cumplía la función de un baño de agua, se colocó un cilindro abierto por su parte superior, con un émbolo que se ajustaba a la pared interna del cilindro (imagen superior).
Este émbolo (formado por el pistón y las dos bases de color negro) podía desplazarse hacia la parte superior o inferior del cilindro en función del volumen de gas que contenía.
El baño de agua podía calentarse mediante el uso de un mechero o planta calefactora, los cuales suministraban el calor necesario para aumentar la temperatura del baño y por ende, la temperatura del cilindro dotado de un émbolo.
Sobre el émbolo se colocó una masa determinada con el fin de asegurar que el experimento se realizara a presión constante. La temperatura del baño y del cilindro era medida mediante el uso de un termómetro colocado en el baño de agua.
Aunque probablemente el cilindro no tenía una graduación para visualizar el volumen de aire, este se podía estimar mediante la medición de la altura que alcanzaba la masa colocada sobre el émbolo y la superficie de la base del cilindro.
El volumen de un cilindro se obtiene multiplicando la superficie de su base por su altura. La superficie de la base del cilindro se pudo obtener aplicando la fórmula: S = Pi x r2.
Mientras la altura se obtiene midiendo la distancia desde la base del cilindro, hasta la parte del émbolo sobre el que descansa la masa.
A medida que se incrementaba la temperatura del baño mediante el calor producido por el mechero, se observaba que el émbolo ascendía dentro del cilindro. Entonces, ellos leían en el termómetro la temperatura en el baño de agua, que se correspondía con la del interior del cilindro.
Asimismo, medían la altura de la masa sobre el émbolo, pudiendo estimar el volumen de aire que le correspondía a la temperatura medida. De esta manera realizaron varias mediciones de la temperatura y estimaciones del volumen de aire correspondiente a cada una de las temperaturas.
Con esto se pudo establecer finalmente que el volumen que ocupa un gas es directamente proporcional a su temperatura. Esta conclusión permitió enunciar la llamada Ley de Charles.
Además del experimento anterior, se tiene uno más simple y cualitativo: el del globo con hielo en invierno.
Si en época de invierno se colocara un globo lleno de helio en una habitación con calefacción, el globo tendría un cierto volumen; pero, si luego se trasladara al exterior de la vivienda con una temperatura baja, se observaría que el globo de helio se encoge, reduciendo su volumen de acuerdo a la Ley de Charles.
Se tiene un gas que ocupa un volumen de 750 cm3 a 25 ºC: ¿cuál será el volumen que ocupa este gas a 37 ºC si se mantiene la presión constante?
Es necesario primero transformar las unidades de temperatura a kelvin:
T1 en grados Kelvin = 25 ºC + 273,15 ºC = 298,15 K
T2 en grados Kelvin = 37 ºC + 273,15 ºC = 310,15 K
Debido a que se conoce V1 y las demás variables, se despeja V2 y se calcula con la siguiente ecuación:
V2 = V1 · (T2 / T1)
= 750 cm3 · (310,15 K / 298,15 K)
= 780,86 cm3
¿Cuál sería la temperatura en grados centígrados a la que habría que calentar 3 litros de un gas a 32 ºC, para que su volumen se expanda a 3,2 litros?
Nuevamente, se transforman los grados centígrados en kelvin:
T1 = 32 ºC + 273,15 ºC = 305,15 K
Y como en el ejercicio anterior, se despeja T2 en lugar de V2, y se calcula a continuación:
T2 = V2 · (T1 / V1)
= 3,2 L · (305,15 K / 3 L)
= 325,49 K
Pero el enunciado pide grados centígrados, por lo que se cambia la unidad de T2:
T2 en grados centígrados = 325, 49 º C (K) – 273,15 ºC (K)
= 52,34 ºC
Si un gas a 0 ºC ocupa un volumen de 50 cm3, ¿qué volumen ocupará a 45 ºC?
Usando la fórmula original de la ley de Charles:
Vt = Vo (1 + t /273)
Se procede a calcular Vt de manera directa al disponerse de todas las variables:
Vt = 50 cm3 + 50 cm3 · (45 ºC / 273 ºC (K))
= 58,24 cm3
Por otro lado, si se resuelve el problema utilizando la estrategia de los ejemplos 1 y 2, tendremos:
V2 = V1 · (T2 / T1)
= 318 K · (50 cm3 / 273 K)
= 58,24 cm3
El resultado, aplicando los dos procedimientos, es el mismo porque en última instancia están basados en el mismo principio de la ley de Charles.
Los globos de los deseos (ya mencionados en la introducción) están dotados de un material textil impregnado de un líquido combustible.
Al incendiar este material, se produce un aumento de la temperatura del aire contenido en el globo, lo cual provoca un aumento del volumen del gas de acuerdo a la ley de Charles.
Por lo tanto, al aumentar el volumen del aire en el globo, disminuye la densidad del aire en el mismo, la cual se hace menor que la densidad del aire circundante, y es por eso que el globo asciende.
Como lo indica su nombre son usados durante la cocción de los pavos. El termómetro posee un recipiente lleno de aire cerrado con una tapa y está calibrado de tal manera que al alcanzar la temperatura óptima de cocción, se levanta la tapa emitiendo un sonido.
El termómetro se coloca en el interior del pavo, y a medida que aumenta la temperatura en el interior del horno, el aire dentro del termómetro se va expandiendo, aumentando su volumen. Entonces cuando el volumen del aire alcanza un valor determinado, hace levantar la tapa del termómetro.
Las pelotas de ping-pong en función de los requerimientos de su uso, son de un peso ligero y sus paredes de plásticos son de poco espesor. Esto hace que al ser impactadas por las raquetas sufran deformaciones.
Al colocar las pelotas deformadas en agua caliente, el aire en su interior se calienta y se produce su expansión, lo que lleva a un aumento del volumen del aire. Esto, asimismo, ocasiona un estiramiento de la pared de las pelotas de ping-pong, lo cual permite la recuperación de su forma original.
Las levaduras son incorporadas en la harina de trigo que se utiliza para hacer panes y tienen la capacidad de producir el gas dióxido de carbono.
Al aumentar la temperatura de los panes durante la cocción, aumenta el volumen del dióxido de carbono. Es debido a esto que se produce una expansión del pan hasta alcanzar el volumen deseado.
- Clark J. (2013). Other gas laws – Boyle’s Law and Charles’ Law. Recuperado de: chemguide.co.uk
- Staroscik Andrew. (2018). Charles’ Law. Recuperado de: scienceprimer.com
- Wikipedia. (2019). Charles Law. Recuperado de: en.wikipedia.org
- Helmenstine, Todd. (27 de diciembre de 2018). What Is the Formula for Charles’ Law? Recuperado de: thoughtco.com
- Prof. N. De Leon. (s.f.). Elementary Gas Laws: Charles Law. C 101 Class Notes. Recuperado de: iun.edu
- Briceño Gabriela. (2018). Ley de Charles. Recuperado de: euston96.com
- Morris, J. G. (1974). Fisicoquímica para biólogos. (2da edición). Editorial Reverté, S.A.
