Treonina: características, funciones, degradación, beneficios
La treonina (Thr, T) o el ácido treo-Ls-α-amino-β-butírico, es uno de los aminoácidos constituyentes de las proteínas celulares. Puesto que el hombre y otros animales vertebrados no poseen rutas biosintéticas para su producción, la treonina es considerada como uno de los 9 aminoácidos esenciales que deben ser adquiridos con la dieta.
La treonina fue el último de los 20 aminoácidos comunes descubiertos en las proteínas, hecho que tuvo lugar en la historia más de un siglo después del descubrimiento de la asparagina (1806), que fue el primer aminoácido descrito.
Fue descubierto por William Cumming Rose en el año 1936, quien acuñó el término “treonina” por la semejanza estructural que encontró entre este aminoácido y el ácido treónico, un compuesto derivado del azúcar treosa.
Como aminoácido proteico, la treonina tiene múltiples funciones en las células, entre las que destacan la de sitio de unión para las cadenas carbohidratadas típicas de las glucoproteínas y la de sitio de reconocimiento para proteínas quinasas con funciones específicas (proteínas treonina/serina quinasas).
Del mismo modo, la treonina es componente esencial de proteínas como el esmalte dental, la elastina y el colágeno y también tiene importantes funciones en el sistema nervioso. Es empleada como suplemento alimenticio y como “mitigador” de los estados fisiológicos de ansiedad y depresión.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Degradación
- 6 Alimentos ricos en treonina
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
La treonina pertenece al grupo de los aminoácidos polares que poseen un grupo R o cadena lateral carente de cargas positivas o negativas (aminoácidos polares no cargados).
Las características de su grupo R lo hacen un aminoácido altamente soluble en agua (hidrofílico o hidrófilo), lo que también es cierto para los demás miembros de este grupo, como son la cisteína, la serina, la asparagina y la glutamina.
Junto con el triptófano, la fenilalanina, la isoleucina y la tirosina, la treonina es uno de los cinco aminoácidos que tiene funciones tanto glucogénicas como cetogénicas, pues a partir de su metabolismo se producen intermediarios relevantes como son el piruvato y el succinil-CoA.
Este aminoácido tiene un peso molecular aproximado de 119 g/mol; como muchos de los aminoácidos sin carga, tiene un punto isoeléctrico alrededor de 5.87 y su frecuencia en las estructuras proteicas es cercana al 6%.
Algunos autores agrupan a la treonina junto con otros aminoácidos de gusto “dulce”, entre los que están, por ejemplo, la serina, la glicina y la alanina.
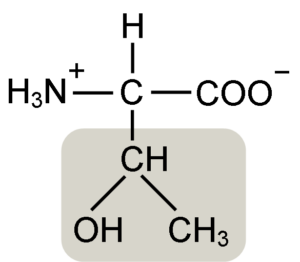
Los α-aminoácidos como la treonina poseen una estructura general, es decir, que es común para todos. Esta se distingue por la presencia de un átomo de carbono conocido como el “carbono α”, que es quiral y al cual se unen cuatro tipos de moléculas o sustituyentes diferentes.
Este carbono comparte uno de sus enlaces con un átomo de hidrógeno, otro con el grupo R, que es característico para cada aminoácido, y los otros dos están ocupados por los grupos amino (NH2) y carboxilo (COOH), que son comunes para todos los aminoácidos.
El grupo R de la treonina posee un grupo hidroxilo que le permite formar puentes de hidrógeno con otras moléculas en medios acuosos. Su identidad puede definirse como un grupo alcohólico (un etanol, de dos átomos de carbono), que ha perdido uno de sus hidrógenos para unirse al átomo de carbono α (-CHOH-CH3).
Este grupo -OH puede servir como “puente” o sitio de unión para gran variedad de moléculas (a este pueden unirse, por ejemplo, cadenas oligosacáridas durante la formación de las glicoproteínas) por lo que es uno de los responsables de la formación de los derivados modificados de la treonina.
La forma biológicamente activa de este aminoácido es la L-treonina y es esta la que participa tanto en la conformación de las estructuras proteicas como en los diversos procesos metabólicos donde actúa.
Como aminoácido proteico, la treonina forma parte de la estructura de muchas proteínas en la naturaleza, donde su importancia y su riqueza dependen de la identidad y de la función de la proteína a la que pertenece.
Además de sus funciones estructurales en la conformación de la secuencia peptídica de las proteínas, la treonina cumple otras funciones tanto en el sistema nervioso como en el hígado, donde participa en el metabolismo de las grasas y previene su acumulación en este órgano.
La treonina forma parte de las secuencias reconocidas por las enzimas serín/treonina quinasas, que se encargan de numerosos procesos de fosforilación de proteínas, esenciales para la regulación de multiplicidad de funciones y eventos de señalización intracelulares.
También es empleada para el tratamiento de algunos desórdenes intestinales y digestivos y se ha demostrado su utilidad en la atenuación de condiciones patológicas como la ansiedad y la depresión.
La L-treonina, asimismo, es uno de los aminoácidos requeridos para mantener el estado pluripotente de las células madre embrionarias de ratón, hecho que aparentemente está relacionado con el metabolismo de la S-adenosil-metionina y con los eventos de metilación de las histonas, que están implicados directamente en la expresión de los genes.
Una propiedad común para muchos aminoácidos es su capacidad de reaccionar con otros grupos químicos como aldehídos o cetonas para la formación de los “sabores” característicos de muchos compuestos.
Entre estos aminoácidos está la treonina, que tal y como la serina, reacciona con la sacarosa durante la tostión de ciertos alimentos y da origen a las “pirazinas”, unos compuestos aromáticos típicos de productos tostados como el café.
La treonina está presente en muchos fármacos de origen natural y también en muchas formulaciones de suplementos alimenticios que son recetadas a pacientes con malnutrición o que tienen dietas pobres en este aminoácido.
Otra de las funciones más notorias de la L-treonina, y que ha ido creciendo en el tiempo, es la de aditivo en la preparación de alimentos concentrados para ganado porcino e industrias de producción avícola.
La L-treonina se emplea en dichas industrias como suplemento alimenticio en formulaciones pobres desde el punto de vista proteico, puesto que ello provee ventajas económicas y alivia las deficiencias en proteína cruda que consumen estos animales de granja.
La principal forma de producción de este aminoácido es, normalmente, por fermentación microbiana y las cifras de producción mundial con fines agropecuarios para el año 2009 superaron las 75 toneladas.
La treonina es uno de los nueve aminoácidos esenciales para el hombre, lo que significa que no puede ser sintetizado por las células del cuerpo y, por ende, que debe ser adquirido a partir de las proteínas de origen animal o vegetal que son suministradas con la dieta diaria.
Las plantas, los hongos y las bacterias sintetizan treonina a partir de rutas similares que pueden presentar algunas discrepancias entre sí. No obstante, la mayor parte de estos organismos parten del aspartato como precursor, no sólo para la treonina, sino también para la metionina y de la lisina.
La ruta de biosíntesis de L-treonina en microorganismos como las bacterias consiste en cinco pasos catalizados por enzimas diferentes. El sustrato de partida, como se comentó, es el aspartato, que es fosforilado por una enzima aspartato quinasa ATP-dependiente.
Esta reacción produce el metabolito L-aspartil fosfato (L-aspartil-P) que sirve de sustrato para la enzima aspartil semialdehído deshidrogenasa, que cataliza su conversión en aspartil semialdehído de forma NADPH dependiente.
El aspartil semialdehído puede ser empleado tanto para la biosíntesis de la L-lisina como para la biosíntesis de la L-treonina; en este caso, la molécula es empleada por una enzima homoserina deshidrogenasa NADPH-dependiente para la producción de L-homoserina.
La L-homoserina es fosforilada a L-homoserina fosfato (L-homoserina-P) por una homoserina quinasa ATP-dependiente y dicho producto de reacción, a su vez, es sustrato de la enzima treonina sintasa, capaz de sintetizar L-treonina.
La L-metionina puede ser sintetizada a partir de la L-homoserina producida en el paso anterior, por lo que representa una vía “competitiva” para la síntesis de L-treonina.
La L-treonina sintetizada de esta manera puede ser empleada para la síntesis de proteínas o también puede ser utilizada aguas abajo para la síntesis de glicina y L-leucina, dos aminoácidos relevantes también desde el punto de vista proteico.
Es importante resaltar que tres de las cinco enzimas que participan de la biosíntesis de L-treonina en las bacterias son reguladas por el producto de la reacción mediante retroalimentación negativa. Estas son la aspartato quinasa, la homoserina deshidrogenasa y la homoserina quinasa.
Además, la regulación de esta ruta biosintética también depende de los requerimientos celulares de los otros productos biosintéticos relacionados con la misma, puesto que la formación de L-lisina, L-metionina, L-isoleucina y glicina es dependiente de la ruta de producción de L-treonina.
La treonina puede ser degradada por dos rutas diferentes para producir piruvato o succinil-CoA. Este último es el producto más importante del catabolismo de la treonina en los seres humanos.
El metabolismo de treonina ocurre principalmente en el hígado, pero el páncreas, aunque en menor medida, también participa en dicho proceso. Esta ruta comienza con el transporte del aminoácido a través de la membrana plasmática de los hepatocitos por medio de transportadores específicos.
La conversión de treonina a piruvato ocurre gracias a su transformación en glicina, lo que tiene lugar en dos pasos catalíticos que comienzan con la formación de 2-amino-3-cetobutirato a partir de la treonina y por acción de la enzima treonina deshidrogenasa.
En el ser humano, esta ruta representa solo entre el 10 y el 30% del catabolismo de la treonina, sin embargo, su importancia es relativa al organismo que se considere ya que, en otros mamíferos, por ejemplo, esta es mucho más relevante catabólicamente hablando.
Tal y como sucede con la metionina, la valina y la isoleucina, los átomos de carbono de la treonina también son empleados para la producción de succunil-CoA. Este proceso comienza con la conversión del aminoácido en α-cetobutirato, que posteriormente es empleado como sustrato de la enzima α-cetoácido deshidrogenasa para rendir propionil-CoA.
La transformación de treonina en α-cetobutirato es catalizada por la enzima treonina deshidratasa, lo que implica la pérdida de una molécula de agua (H2O) y otra de un ion amonio (NH4+).
El propionil-CoA es carboxilado en metilmalonil-CoA a través de una reacción de dos pasos que requieren del ingreso de un átomo de carbono en forma de bicarbonato (HCO3-). Este producto sirve de sustrato para una metilmalonil-CoA mutasa-coenzima B12 dependiente, que “epimeriza” la molécula para producir succinil-CoA.
Adicionalmente, el esqueleto carbonado de la treonina puede ser empleado catabólicamente para la producción de acetil-CoA, que también tiene importantes implicaciones desde el punto de vista energético en las células del cuerpo.
En determinados organismos la treonina también funciona como sustrato de algunas rutas biosintéticas como la de la isoleucina, por ejemplo. En este caso, a través de 5 pasos catalíticos, el α-cetobutirato derivado del catabolismo de la treonina puede ser dirigido hacia la formación de isoleucina.
A pesar de que la mayor parte de los alimentos abundantes en proteínas tienen cierto porcentaje de todos los aminoácidos, se ha determinado que los huevos, la leche, la soja y la gelatina son especialmente ricos en el aminoácido treonina.
La treonina también está en las carnes de animales como el pollo, el cerdo, el conejo, el cordero y distintos tipos de aves. En los alimentos de origen vegetal es abundante en las coles, en la cebolla, el ajo, la acelga y las berenjenas.
También se encuentra en el arroz, el maíz, el salvado de trigo, los granos de leguminosas y en muchas frutas como las fresas, las bananas, las uvas, la piña, las ciruelas y otros frutos secos ricos en proteínas tales como las nueces o los pistachos, entre otros.
Según el comité de expertos de la Organización Mundial de la Salud para la Agricultura y la Alimentación (WHO, FAO), el requerimiento diario de treonina para un ser humano adulto promedio está alrededor de los 7 mg por kilogramo de peso corporal, que debe ser adquirida a partir de los alimentos ingeridos con la dieta.
Estas cifras derivan de datos experimentales obtenidos a partir de estudios realizados con hombres y mujeres, donde esta cantidad de treonina es suficiente para conseguir un balance positivo de nitrógeno en las células corporales.
No obstante, estudios realizados con niños entre 6 meses y un año de edad han demostrado que para estos los requerimientos mínimos de L-treonina están entre los 50 y 60 mg por kilogramo de peso por día.
Entre los principales beneficios de la ingesta de suplementos nutricionales o fármacos con formulaciones especiales ricas en L-treonina están el tratamiento de la esclerosis amiotrófica lateral o enfermedad de Lou Gehrig.
El suministro adicional de treonina favorece la absorción de nutrientes en el intestino y también contribuye en el mejoramiento de las funciones hepáticas. Es importante, además, para el transporte de grupos fosfato a través de las células.
En los niños pequeños existen defectos natos en el metabolismo de la treonina que causan retraso en el crecimiento y otros desórdenes metabólicos relacionados.
Deficiencias en este aminoácido han sido asociadas con algunas fallas en la ganancia de peso infantil, además de otras patologías relacionadas con la falta de retención de nitrógeno y su pérdida en la orina.
Los seres humanos sometidos a dietas pobres en treonina pueden tener una mayor propensión a sufrir de hígado graso y algunas infecciones intestinales relacionadas con este aminoácido.
- Barret, G., & Elmore, D. (2004). Amino Acids and Peptides. Cambridge: Cambridge University Press.
- Borgonha, S., Regan, M. M., Oh, S. H., Condon, M., & Young, V. R. (2002). Threonine requirement of healthy adults, derived with a 24-h indicator amino acid balance technique. American Journal of Clinical Nutrition, 75(4), 698–704.
- Bradford, H. (1931). The History of the Discovery of the Amino Acids. II. A Review of Amino Acids Described Since 1931 as Components of Native Proteins. Advances in Protein Chemistry, 81–171.
- Champe, P., & Harvey, R. (2003). Amino Acids Amino Acids. In Lippincott’s Illustrated Reviews: Biochemistry (3rth ed., pp. 1–12). Lippincott.
- De Lange, C. F. M., Gillis, A. M., & Simpson, G. J. (2001). Influence of threonine intake on whole-body protein deposition and threonine utilization in growing pigs fed purified diets. Journal of Animal Science, 79, 3087–3095.
- Edelman, A., Blumenthal, D., & Krebs, E. (1987). Protein Serine/Threonine Kinases. Annu. Rev., 56, 567–613.
- Edsall, J. (1960). Amino Acids, Proteins and Cancer Biochemistry (Vol. 241). London: Academic Press, Inc.
- House, J. D., Hall, B. N., & Brosnan, J. T. (2001). Threonine metabolism in isolated rat hepatocytes. American Journal of Physiology – Endocrinology and Metabolism, 281, 1300–1307.
- Hudson, B. (1992). Biochemistry of food proteins. Springer-Science+Business Media, B.V.
- Kaplan, M., & Flavin, M. (1965). Threonine Biosynthesis. On the Pathway in Fungi and Bacteria and the Mechanism of the Isomerization Reaction. The Journal of Biological Chemistry, 240(10), 3928–3933.
- Kidd, M., & Kerr, B. (1996). L-Threonine for Poultry: a Review. Applied Poultry Science, Inc., 358–367.
- Pratt, E., Snyderman, S., Cheung, M., Norton, P., & Holt, E. (1954). The Threonine Requirement of the normal infant. The Journal of Nutrition, 10(56), 231–251.
- Rigo, J., & Senterre, J. (1980). Optimal Threonine Intake for Preterm Infants Fed on Oral or Parenteral Nutrition. Journal of Parenteral and Enteral Nutrition, 4(1), 15–17.
- Shyh-Chang, N., Locasale, J. W., Lyssiotis, C. A., Zheng, Y., Teo, R. Y., Ratanasirintrawoot, S., … Cantley, L. C. (2013). Influence of Threonine Metabolism on S-adenosylmethionine and Histone Methylation. Science, 339, 222–226.
- Vickery, H. B., & Schmidt, C. L. A. (1931). The history of the discovery of the amino acids. Chemical Reviews, 9(2), 169–318.
- Web MD. (n.d.). Retrieved September 10, 2019, from www.webmd.com/vitamins/ai/ingredientmono-1083/threonine
- Wormser, E. H., & Pardee, A. B. (1958). Regulation of threonine biosynthesis in Escherichia coli. Archives of Biochemistry and Biophysics, 78(2), 416–432.
- Xunyan, X., Quinn, P., & Xiaoyuan, X. (2012). Research Gate. Retrieved September 10, 2019, from www.researchgate.net/figure/The-biosynthesis-pathway-of-L-threonine-The-pathway-consists-of-fi-ve-enzymatic-steps_fig1_232320671
