Esfingolípidos: características, funciones, grupos, síntesis
Los esfingolípidos representan una de las tres grandes familias de lípidos presentes en las membranas biológicas. Al igual que los glicerofosfolípidos y los esteroles, son moléculas anfipáticas con una región polar hidrofílica y una región apolar hidrofóbica.
Fueron descritos por primera vez en 1884 por Johann L. W. Thudichum, quien describió tres esfingolípidos (la esfingomielina, los cerebrósidos y la cerebrosulfatida) que pertenecen a las tres clases diferentes que se conocen: fosfoesfingolípidos, glucoesfingolípidos neutros y acídicos.
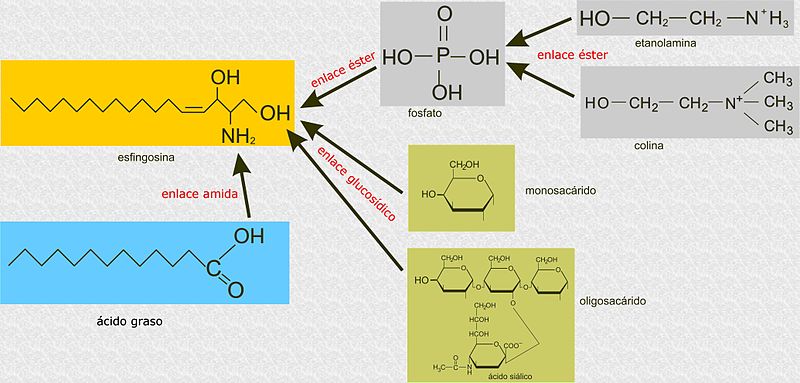
A diferencia de los glicerofosfolípidos, los esfingolípidos no están construidos sobre una molécula de glicerol 3-fosfato como esqueleto principal, sino que son compuestos derivados de la esfingosina, un aminoalcohol con una larga cadena hidrocarbonada unida por un enlace amida.
En términos de complejidad y diversidad se conocen al menos 5 tipos de bases diferentes para los esfingolípidos en los mamíferos. A estas bases se pueden unir más de 20 tipos de ácidos grasos distintos, con longitudes y grados de saturación variables, además de las múltiples variaciones en los grupos polares que se pueden dar.
Las membranas biológicas poseen alrededor de 20% de esfingolípidos. Estos tienen variadas e importantes funciones en las células, desde estructurales hasta transducción de señales, y control de diferentes procesos de comunicación celular.
La distribución de estas moléculas varía dependiendo de la función de la organela donde se encuentren, pero normalmente la concentración de esfingolípidos es mucho mayor en la monocapa externa de la membrana plasmática con respecto a la monocapa interna y a otros compartimientos.
En los seres humanos existen al menos 60 especies de esfingolípidos. Muchos de ellos son importantes componentes de las membranas de las células nerviosas, mientras que otros juegan importantes papeles estructurales o participan en la transducción de señales, reconocimiento, diferenciación celular, patogénesis, muerte celular programada, entre otros.
Índice del artículo
- 1 Estructura
- 2 Características
- 3 Funciones
- 4 Grupos de esfingolípidos
- 5 Síntesis
- 6 Metabolismo
- 7 Referencias
Todos los esfingolípidos derivan de una L-serina, que es condensada con un ácido graso de cadena larga para formar la base esfingoide, también conocida como base de cadena larga (LCB).
Las bases más comunes son la esfinganina y la esfingosina, que difieren entre sí solo en la presencia de un doble enlace trans entre los carbonos 4 y 5 del ácido graso de la esfingosina.
Los carbonos 1, 2 y 3 de la esfingosina son estructuralmente análogos a los carbonos del glicerol de los glicerofosfolípidos. Cuando por enlaces amida se une un ácido graso al carbono 2 de la esfingosina, se produce una ceramida, que es una molécula muy similar al diacilglicerol y representa al esfingolípido más sencillo.
Los ácidos grasos de cadena larga que constituyen las regiones hidrofóbicas de estos lípidos pueden ser muy diversos. Las longitudes varían de 14 a 22 átomos de carbono que pueden tener diferentes grados de saturación, usualmente entre los carbonos 4 y 5.
En las posiciones 4 o 6 pueden tener grupos hidroxilos y dobles enlaces en otras posiciones o incluso ramificaciones como grupos metilo.
Las cadenas de ácidos grasos unidas por enlaces amida a las ceramidas son comúnmente saturadas, y tienden a ser de mayor longitud que las que se encuentran en los glicerofosfolípidos, lo que parece ser crucial para la actividad biológica de estos.
Una característica distintiva del esqueleto de los esfingolípidos es que pueden tener carga neta positiva a pH neutro, raro entre las moléculas lipídicas.
Sin embargo, el pKa del grupo amino es bajo respecto a una amina simple, entre 7 y 8, por lo que una porción de la molécula no está cargada a pH fisiológico, lo que pudiese explicar el movimiento “libre” de estos entre las bicapas.
La clasificación tradicional de los esfingolípidos surge de las múltiples modificaciones que puede sufrir la molécula de ceramida, sobre todo en cuanto a las sustituciones de los grupos de la cabeza polar.
Los esfingolípidos son esenciales en animales, plantas y hongos, así como en algunos organismos procariotas y virus.
Los esfingolípidos modulan las propiedades físicas de las membranas, incluyendo su fluidez, grosor y curvatura. Modular estas propiedades también les otorga influencia directa sobre la organización espacial de las proteínas de membrana.
En las “balsas” lipídicas
En las membranas biológicas pueden detectarse micro dominios dinámicos con menor fluidez formados por moléculas de colesterol y esfingolípidos denominadas balsas lipídicas.
Estas estructuras ocurren naturalmente y mantienen estrecha relación con proteínas integrales, receptores de superficie celular y proteínas de señalización, transportadores y otras proteínas con anclas de glicosilfosfatidilinositol (GPI).
Tienen funciones como moléculas señalizadoras que actúan como segundos mensajeros o como ligandos secretados para los receptores de la superficie celular.
Como mensajeros secundarios pueden participar en la regulación de la homeóstasis del calcio, crecimiento celular, tumorogénesis y supresión de la apoptosis. Además, la actividad de muchas proteínas de membrana integrales y periféricas depende de su asociación con esfingolípidos.
Muchas interacciones intercelulares y de la célula con su entorno dependen de la exposición de los diferentes grupos polares de los esfingolípidos hacia la cara externa de la membrana plasmática.
La unión de los glucoesfingolípidos y las lectinas es crucial para la asociación de la mielina con los axones, la adhesión de neutrófilos al endotelio, etc.
Subproductos de su metabolismo
Los esfingolípidos de señalización más importantes son las bases de cadena larga o las esfingosinas y las ceramidas, así como sus derivados fosforilados, como por ejemplo la esfingosina 1-fosfato.
Los productos del metabolismo de muchos esfingolípidos activan o inhiben múltiples blancos aguas abajo (proteínas quinasas, fosfoproteínas fosfatasas y otras), que controlan comportamientos celulares tan complejos como el crecimiento, la diferenciación y la apoptosis.
Algunos patógenos emplean glucoesfingolípidos como receptores para mediar su entrada a las células hospedadoras o para entregar factores de virulencia a las mismas.
Se ha demostrado que los esfingolípidos participan en múltiples eventos celulares como la secreción, endocitosis, quimiotaxis, neurotransmisión, angiogénesis e inflamación.
Están involucrados también en el tráfico de membranas, por lo que influencian la internalización de receptores, el ordenamiento, movimiento y la fusión de las vesículas secretoras en respuesta a diferentes estímulos.
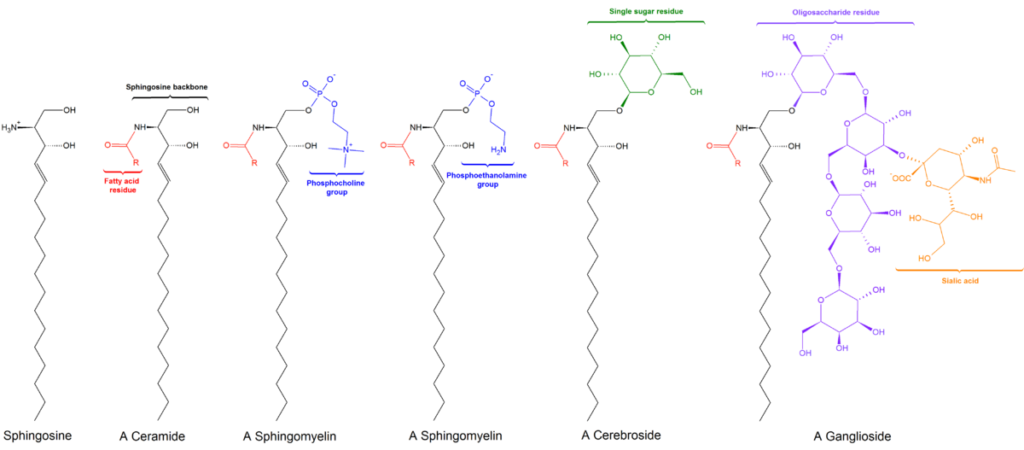
Hay tres subclases de esfingolípidos, todas derivadas de la ceramida y que difieren entre sí por los grupos polares, a saber: las esfingomielinas, los glucolípidos y los gangliósidos.
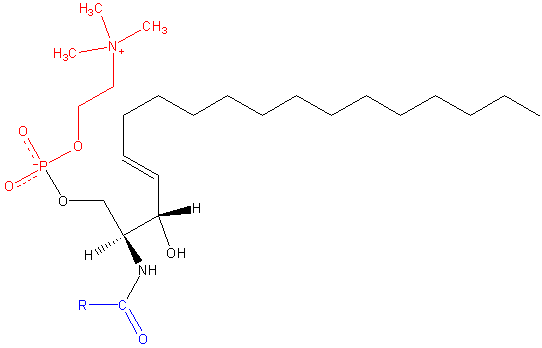
Estos contienen fosfocolina o fosfoetanolamina como grupo de cabeza polar, por lo que se clasifican como fosfolípidos junto con los glicerofosfolípidos. Se parecen, por supuesto, a las fosfatidilcolinas en estructura tridimensional y en propiedades generales ya que no tienen carga en sus cabezas polares.
Se hallan presentes en las membranas plasmáticas de las células animales y son especialmente abundantes en la mielina, una vaina que rodea y aísla los axones de algunas neuronas.
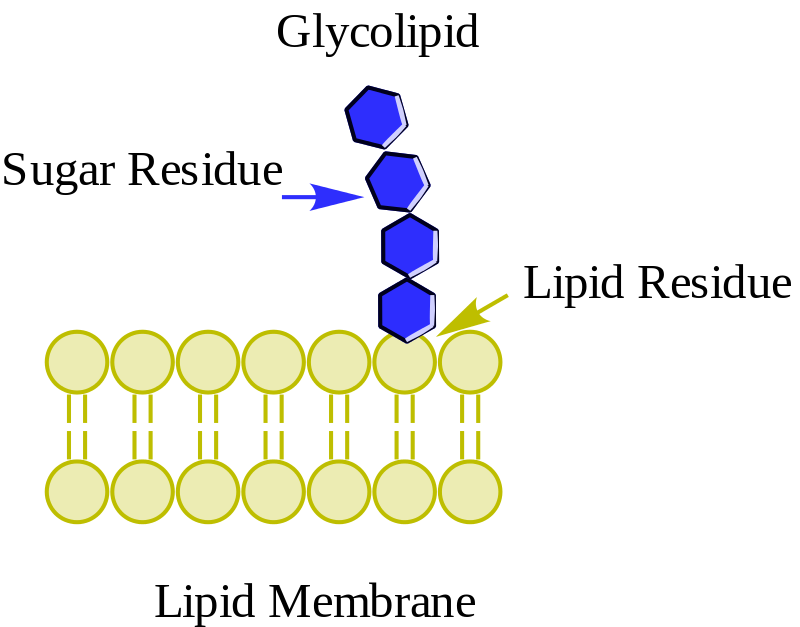
Se encuentran primordialmente en la cara externa de la membrana plasmática y poseen uno o más azúcares como grupo de cabeza polar unidos directamente al hidroxilo del carbono 1 de la porción ceramida. No poseen grupos fosfato. Puesto que a pH 7 no tienen carga, reciben el nombre de glucolípidos neutros.
Los cerebrósidos tienen una sola molécula de azúcar unida a la ceramida. Los que contienen galactosa se encuentran en membranas plasmáticas de células de tejidos no nerviosos. Los globósidos son glucoesfingolípidos con dos o más azúcares, normalmente D-glucosa, D-galactosa o N-acetil-D-galactosamina.
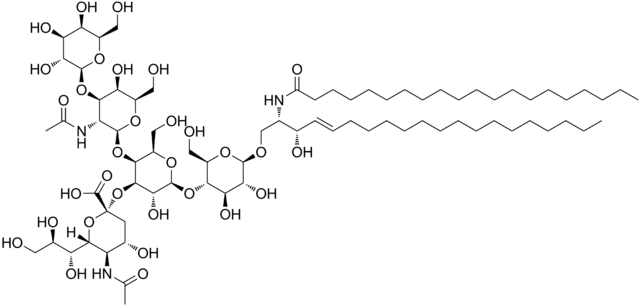
Estos son los esfingolípidos más complejos. Poseen oligosacáridos como grupo de cabeza polar y uno o más residuos de ácido N-acetilmurámico terminales, llamado también ácido siálico. El ácido siálico aporta a los gangliósidos la carga negativa a pH 7, que los distingue de los glucoesfingolípidos neutros.
La nomenclatura de esta clase de esfingolípidos depende de la cantidad de residuos de ácido siálico presentes en la porción oligosacárida de la cabeza polar.
La molécula base de cadena larga o esfingosina, es sintetizada en el retículo endoplasmático (ER) y la adición del grupo polar a la cabeza de estos lípidos ocurre posteriormente en el complejo de Golgi. En mamíferos, alguna síntesis de esfingolípidos puede ocurrir también en la mitocondria.
Tras completar su síntesis en el complejo de Golgi, los esfingolípidos son transportados hacia otros compartimentos celulares a través de mecanismos mediados por vesículas.
La biosíntesis de los esfingolípidos consiste de tres eventos fundamentales: la síntesis de las bases de cadena larga, la biosíntesis de las ceramidas por la unión de un ácido graso a través de un enlace amida, y finalmente, la formación de los esfingolípidos complejos por medio de la unión de los grupos polares en el carbono 1 de la base esfingoide.
Además de la síntesis de novo, los esfingolípidos también pueden formarse por el recambio o reciclaje de las bases de cadena larga y las ceramidas, que pueden alimentar el pool de esfingolípidos.
La biosíntesis de la ceramida, el esqueleto de los esfingolípidos, comienza con la condensación descarboxilativa de una molécula de palmitoil-CoA y una L-serina. La reacción es catalizada por una serina palmitoil transferasa (SPT) heterodimérica, dependiente de fosfato piridoxal y el producto es la 3-ceto dihidroesfingosina.
Esta enzima es inhibida por β-halo-L-alaninas y L-cicloserinas. En levaduras está codificada por dos genes, mientras que en mamíferos existen tres genes para esta enzima. El sitio activo se encuentra en la cara citoplasmática del retículo endoplasmático.
El rol de esta primera enzima está conservado en todos los organismos estudiados. No obstante, existen algunas diferencias entre las taxa que tienen que ver con la ubicación subcelular de la enzima: la de bacterias es citoplasmática, la de levaduras, plantas y animales está en el retículo endoplasmático.
La 3-cetoesfinganina es subsecuentemente reducida por la 3-cetoesfinganina reductasa dependiente de NADPH para producir esfinganina. La dihidroceramida sintasa (esfinganina N-acil transferasa) acetila después la esfinganina para producir dihidroceramida. La ceramida se forma luego por la dihidroceramida desaturasa/reductasa, que inserta un doble enlace trans en la posición 4-5.
En los mamíferos existen numerosas isoformas de ceramidas sintasas, cada una uniendo una cadena específica de ácidos grasos a las bases de cadenas largas. Por lo tanto, las ceramidas sintasas y otras enzimas, las elongasas, proveen la principal fuente de diversidad de los ácidos grasos en los esfingolípidos.
La esfingomielina es sintetizada por la transferencia de una fosfocolina desde la fosfatidilcolina hasta la ceramida, liberando diacilglicerol. La reacción une las rutas de señalización de esfingolípidos y glicerofosfolípidos.
La ceramida fosfoetanolamina es sintetizada a partir de la fosfatidiletanolamina y la ceramida en una reacción análoga a la de la síntesis de esfingomielina, y una vez formada puede ser metilada a esfingomielina. Las inositol fosfato ceramidas son formadas por transesterificación a partir del fosfatidilinositol.
Los glucoesfingolípidos son modificados principalmente en el complejo de Golgi, donde enzimas glicosiltransferasas específicas participan de la adición de las cadenas oligosacáridas en la región hidrofílica del esqueleto ceramida.
La degradación de los esfingolípidos es realizada por las enzimas glucohidrolasas y esfingomielinasas, que son las encargadas de remover las modificaciones de los grupos polares. Por otra parte, las ceramidasas regeneran las bases de cadena larga a partir de las ceramidas.
Los gangliósidos son degradados por un conjunto de enzimas lisosómicas que catalizan la eliminación paso a paso de las unidades de azúcar, produciendo al final una ceramida.
Otra vía de degradación consiste en la internalización de los esfingolípidos en vesículas endocíticas que son enviadas de nuevo hacia la membrana plasmática o transportadas hacia los lisosomas donde son degradados por hidrolasas ácidas específicas.
No todos las bases de cadena larga son recicladas, el retícuo endoplasmático posee una ruta para la degradación terminal de estos. Este mecanismo de degradación consiste en una fosforilación en vez de acilación de las LCBs, dando lugar a moléculas señalizadoras que pueden ser sustratos solubles para las enzimas liasas que cortan las LCBs-fosfato para generar aciloaldehídos y fosfoetanolamina.
El metabolismo de estos lípidos es regulado en varios niveles, uno de ellos es el de las enzimas encargadas de la síntesis, sus modificaciones postraduccionales y los mecanismos alostéricos de las mismas.
Algunos mecanismos de regulación son celular-específicos, bien para controlar el momento del desarrollo celular en el cual son producidos o en respuesta a señales específicas.
- Bartke, N., & Hannun, Y. (2009). Bioactive Sphingolipids: Metabolism and Function. Journal of Lipid Research, 50, 19.
- Breslow, D. K. (2013). Sphingolipid Homeostasis in the Endoplasmic Reticulum and Beyond. Cold Spring Harbor Perspectives in Biology, 5(4), a013326.
- Futerman, A. H., & Hannun, Y. A. (2004). The complex life of simple sphingolipids. EMBO Reports, 5(8), 777–782.
- Harrison, P. J., Dunn, T., & Campopiano, D. J. (2018). Sphingolipid biosynthesis in man and microbes. Natural Product Reports, 35(9), 921–954.
- Lahiri, S., & Futerman, A. H. (2007). The metabolism and function of sphingolipids and glycosphingolipids. Cellular and Molecular Life Sciences, 64(17), 2270–2284.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Molecular Cell Biology (5th ed.). Freeman, W. H. & Company.
- Luckey, M. (2008). Membrane structural biology: with biochemical and biophysical foundations. Cambridge University Press. Retrieved from www.cambridge.org/9780521856553
- Merrill, A. H. (2011). Sphingolipid and glycosphingolipid metabolic pathways in the era of sphingolipidomics. Chemical Reviews, 111(10), 6387–6422.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
- Vance, J. E., & Vance, D. E. (2008). Biochemistry of lipids, lipoproteins and membranes. In New Comprehensive Biochemistry Vol. 36 (4th ed.). Elsevier.
