Hidróxido de mercurio: estructura, propiedades, usos, riesgos
El hidróxido de mercurio es un compuesto inorgánico en el cual el metal mercurio (Hg) tiene un número de oxidación de 2+. Su fórmula química es Hg(OH)2. Sin embargo, esta especie no ha podido aún obtenerse en forma sólida bajo condiciones normales.
El hidróxido de mercurio o hidróxido mercúrico es un intermediario transitorio de vida corta en la formación del óxido mercúrico HgO en solución alcalina. Por los estudios realizados en soluciones de óxido mercúrico HgO, se ha deducido que el Hg(OH)2 es una base débil. Otras especies que lo acompañan son el HgOH+ y el Hg2+.

A pesar de no haber podido ser precipitado en solución acuosa, el Hg(OH)2 se ha obtenido por reacción fotoquímica del mercurio con el hidrógeno y el oxígeno a temperaturas muy bajas. También se ha obtenido en forma de coprecipitado junto con el Fe(OH)3, donde la presencia de iones haluro ejerce influencia en el pH en el que ocurre la coprecipitación.
Dado que no se ha obtenido puro fácilmente a nivel de laboratorio, no ha sido posible encontrar alguna utilidad para este compuesto, ni determinar los riesgos de su uso. Sin embargo, se puede deducir que presenta los mismos riesgos que los demás compuestos de mercurio.
Índice del artículo
- 1 Estructura de la molécula
- 2 Configuración electrónica
- 3 Nomenclatura
- 4 Propiedades
- 5 Obtención
- 6 Usos
- 7 Estudios recientes
- 8 Riesgos
- 9 Referencias
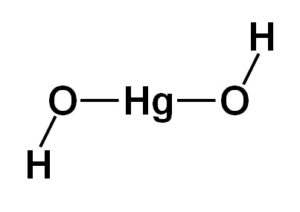
La estructura del hidróxido de mercurio (II) Hg(OH)2 está basada en una porción central lineal formada por el átomo de mercurio con los dos átomos de oxígeno a los lados.
A esta estructura central están unidos los átomos de hidrógeno, cada uno al lado de cada oxígeno, los cuales giran libremente alrededor de cada oxígeno. Se podría representar de forma sencilla como se indica a continuación:
La estructura electrónica del mercurio metálico Hg es la siguiente:
[Xe] 5d10 6s2
donde [Xe] es la configuración electrónica del gas noble xenón.
Al observar dicha estructura electrónica se deriva que el estado de oxidación más estable del mercurio es aquel en donde se pierden los 2 electrones de la capa 6s.
En el hidróxido mercúrico Hg(OH)2, el átomo de mercurio (Hg) se encuentra en su estado de oxidación 2+. Por lo tanto, en el Hg(OH)2 el mercurio posee la siguiente configuración electrónica:
[Xe] 5d10
– Hidróxido de mercurio (II)
– Hidróxido mercúrico
– Dihidróxido de mercurio
236,62 g/mol
Según la información consultada, es posible que el Hg(OH)2 sea un compuesto transitorio en la formación de HgO en medio acuoso alcalino.
La adición de iones hidroxilo (OH–) a una solución acuosa de iones mercúrico Hg2+ conduce a la precipitación de un sólido amarillo de óxido de mercurio (II) HgO, de la cual el Hg(OH)2 es un agente pasajero o temporal.

En solución acuosa el Hg(OH)2 es un intermediario de muy corta vida, pues rápidamente libera una molécula de agua y precipita el HgO sólido.
Aunque no ha sido posible precipitar el hidróxido mercúrico Hg(OH)2, el óxido de mercurio (II) HgO es algo soluble en agua formando una solución de especies llamadas “hidróxidos”.
Estas especies en agua denominadas “hidróxidos” son bases débiles y, aunque a veces se comportan como anfóteras, en general el Hg(OH)2 es más básico que ácido.
Cuando se disuelve el HgO en HClO4 los estudios indican la presencia de ión mercúrico Hg2+, un ion monohidroximercúrico HgOH+ y el hidróxido mercúrico Hg(OH)2.
Los equilibrios que ocurren en tales soluciones acuosas son los siguientes:
Hg2+ + H2O ⇔ HgOH+ + H+
HgOH+ + H2O ⇔ Hg(OH)2 + H+
En soluciones alcalinas de NaOH se forma la especie Hg(OH)3–.
El hidróxido de mercurio (II) Hg(OH)2 no se puede obtener en solución acuosa, pues al añadir álcali a una solución de iones mercúrico Hg2+, precipita el óxido mercúrico amarillo HgO.
No obstante, algunos investigadores lograron obtener en 2005 por primera vez el hidróxido mercúrico Hg(OH)2 empleando una lámpara de arco de mercurio, partiendo del elemento mercurio Hg, hidrógeno H2 y oxígeno O2.

La reacción es fotoquímica y fue realizada en presencia de neón, argón o deuterio sólidos a temperaturas muy bajas (alrededor de 5 K = 5 grados Kelvin). Las evidencias de formación del compuesto se obtuvieron mediante espectros de absorción de luz IR (infrarroja).
El Hg(OH)2 preparado de esta forma es muy estable bajo las condiciones de la experiencia. Se estima que la reacción fotoquímica procede a través del intermediario O-Hg-O hasta la molécula estable H-O-Hg-O-H.
Si se disuelven sulfato de mercurio (II) HgSO4 y sulfato de hierro (III) Fe2(SO4)3 en solución acuosa ácida, y se comienza a aumentar el pH agregando una solución de hidróxido de sodio NaOH, luego de un tiempo de reposo se forma un sólido que se infiere sea un coprecipitado de Hg(OH)2 y Fe(OH)3.
Se ha encontrado que la formación de Hg(OH)2 es un paso crítico en esta coprecipitación con Fe(OH)3.
La formación de Hg(OH)2 en el precipitado Fe(OH)3-Hg(OH)2 depende fuertemente de la presencia de iones como fluoruro, cloruro o bromuro, de la concentración específica de estos y del pH de la solución.
En presencia de fluoruro (F–), a pH mayor de 5, la coprecipitación de Hg(OH)2 con el Fe(OH)3 no se ve afectada. Pero a un pH de 4 la formación de complejos entre el Hg2+ y el F– interfiere en la coprecipitación de Hg(OH)2.
En el caso de la presencia del cloruro (Cl–), la coprecipitación de Hg(OH)2 ocurre a un pH de 7 o mayor, es decir, preferiblemente en medio alcalino.
Cuando está presente el bromuro (Br–), la coprecipitación del Hg(OH)2 se presenta a pH aún mayor, esto es, pH por encima de 8,5, o más alcalino que con cloruro.
De la revisión de las fuentes de información disponibles se deduce que el hidróxido de mercurio (II) Hg(OH)2, por ser un compuesto aún no preparado a nivel comercial, no tiene usos conocidos.
Mediante técnicas computacionales de simulación en 2013 se estudiaron las características estructurales y energéticas relacionadas con la hidratación del Hg(OH)2 en estado gaseoso.
Se calcularon y compararon las coordinaciones metal-ligando y las energías de solvatación al variar el grado de hidratación del Hg(OH)2.
Entre otras cosas, se encontró que aparentemente el estado de oxidación teórico es de 1+ en lugar del presunto 2+ usualmente asignado para el Hg(OH)2.
Aunque el Hg(OH)2 como tal no ha sido aislado en suficiente cantidad y por tanto no ha sido comercialmente utilizado, no se han podido determinar sus riesgos específicos, pero se puede inferir que presenta los mismos riesgos que el resto de las sales de mercurio.
Puede ser tóxico para el sistema nervioso, aparato digestivo, piel, ojos, aparato respiratorio y riñones.
La inhalación, ingestión o contacto con la piel de compuestos de mercurio puede producir daños que van desde la irritación de ojos y piel, insomnio, dolores de cabeza, temblores, daños en el tracto intestinal, pérdida de memoria, hasta la insuficiencia renal, entre otros síntomas.
El mercurio ha sido reconocido internacionalmente como un contaminante. La mayoría de los compuestos de mercurio que entran en contacto con el medio ambiente son metilados por las bacterias presentes en suelos y sedimentos, formando metilmercurio.
Este compuesto se bioacumula en los organismos vivos, pasando del suelo a las plantas y de allí a los animales. En el medio acuático la transferencia es aún más rápida, pasando de especies muy pequeñas a las grandes en poco tiempo.
El metilmercurio tiene un efecto tóxico para los seres vivos y en particular para el ser humano, que lo ingiere a través de la cadena alimenticia.
Al ser ingerido con los alimentos es especialmente dañino para niños pequeños y para los fetos en las mujeres embarazadas, pues siendo una neurotoxina puede causar daños del cerebro y sistema nervioso en formación y crecimiento.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Wang, Xuefeng and Andrews, Lester (2005). Infrared Spectrum of Hg(OH)2 in Solid Neon and Argon. Inorganic Chemistry, 2005, 44, 108-113. Recuperado de pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Aqueous Solvation of Hg(OH)2: Energetic and Dynamical Density Functional Theory Studies of the Hg(OH)2–(H2O)n (n = 1-24) Structures. J. Phys. Chem. A 2013, 117, 9069-9075. Recuperado de pubs.acs.org.
- Inoue, Yoshikazu and Munemori, Makoto. (1979). Coprecipitation of Mercury(II) with Iron(III) Hydroxide. Environmental Science & Technology. Volume 13, Number 4, April 1979. Recuperado de pubs.acs.org.
- Chang, L.W., et al. (2010). Nervous System and Behavioral Toxicology. In Comprehensive Toxicology. Recuperado de sciencedirect.com.
- Haney, Alan and Lipsey, Richard L. (1973). Accumulation and effects of methyl mercury hydroxide in a terrestrial food chain under laboratory conditions. Environ. Pollut. (5) (1973) pp. 305-316. Recuperado de sciencedirect.com.
