Beta amiloide: origen, estructura y toxicidad
Beta amiloide (AB) o péptido beta amiloide (ABP) es el nombre que reciben los péptidos de 39-43 aminoácidos y entre 4-6 kDa de peso molecular que son producto del metabolismo de la proteína precursora del amiloide (APP) cuando es procesada por la vía amiloidogénica.
El término amiloide (tipo almidón) se refiere a que los depósitos de esta proteína se asemejan a los gránulos de almidón vistos por primera vez en tejidos vegetales de reserva. En la actualidad, el término está asociado con los péptidos y las proteínas que adoptan una morfología particular de fibras en el sistema nervioso.
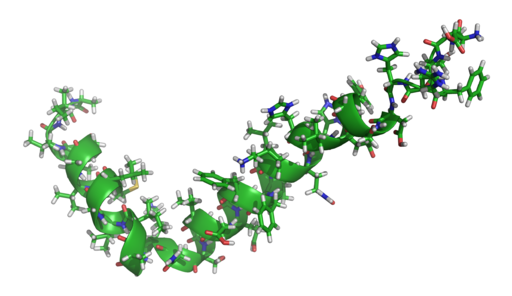
El ABP corresponde al segmento C-terminal transmembranal de la proteína APP. El gen que codifica para la APP está localizado en el cromosoma 21 y sufre “splicing” alternativos que dan como resultado varias isoformas de la proteína.
Las diferentes variantes o isoformas se expresan en todo el organismo. La isoforma cerebral predominante es una que carece del dominio inhibidor de serín-proteasas.
Pequeñas cantidades del ABP tienen un importante papel en el desarrollo neuronal y en la regulación de la transmisión colinérgica, que es fundamental en el sistema nervioso central. Su abundancia depende de un equilibrio entre su síntesis y degradación, que es controlado enzimáticamente.
Parte importante de los marcadores fisiopatológicos de la enfermedad de Alzheimer congénita y tardía se relacionan con el ABP, especialmente con la formación de placas seniles debido a su deposición excesiva en las células neuronales, la formación de ovillos o enmarañados fibrilares y la degeneración sináptica.
Índice del artículo
El ABP se origina a partir del corte enzimático de la proteína precursora APP, que se expresa en altos niveles en el cerebro y es rápidamente metabolizada de forma compleja.
Esta proteína pertenece a la familia de glicoproteínas transmembranales de tipo 1 y su función aparentemente es actuar como receptor vesicular para el motor de la proteína Kinesina I. También está implicado en la regulación de la sinapsis, transporte neuronal y exportación celular de iones de hierro.
La proteína APP es sintetizada en el retículo endoplasmático, es glicosilada y enviada al complejo de Golgi para su posterior empaquetamiento en vesículas de transporte que la entregan a la membrana plasmática.
Tiene un solo dominio transmembranal, un largo extremo N-terminal y una pequeña porción C-terminal intracelular. Es procesada enzimáticamente de dos formas distintas: la vía no-amiloidogénica y la vía amiloidogénica.
En la vía no-amiloidogénica la proteína APP es cortada por α- y γ-secretasas membranales, que cortan un segmento soluble y el fragmento transmembranal, liberando la porción C-terminal que probablemente es degrada en los lisosomas. Se dice que es no-amiloidogénica puesto que ninguno de los cortes da lugar al péptido ABP completo.
La vía amiloidogénica, por el contrario, implica además la acción secuencial de la β-secretasa BACE1 y el complejo γ-secretasa, que son también proteínas integrales de membrana.
El corte inducido por la α-secretasa libera de la superficie celular un fragmento proteico conocido como sAPPα, dejando un segmento de menos de 100 aminoácidos del extremo C-terminal inserto en la membrana.
Esta porción membranal es cortada por la β-secretasa, cuyo producto puede ser procesado múltiples veces por el complejo γ-secretasa, originando fragmentos de distintas longitudes (desde 43 hasta 51 aminoácidos).
Los diferentes péptidos cumplen funciones distintas: algunos pueden ser translocados al núcleo, ejerciendo un papel de regulación genética; otros parecen tener participación en el transporte de colesterol a través de la membrana, mientras que otros participan de la formación de placas o aglomerados, tóxicos para la actividad neuronal.
La secuencia aminoacídica primaria del péptido AB fue descubierta en 1984 al estudiar los componentes de las placas amiloides de pacientes con la enfermedad de Alzheimer.
Dado que el complejo γ-secretasa puede realizar cortes promiscuos en los segmentos liberados por la β-secretasa, existen diversidad de moléculas ABP. Dado que su estructura no puede ser cristalizada por métodos comunes, se piensa que pertenecen a la clase de proteínas intrínsecamente no-estructuradas.
Modelos derivados de estudios empleando resonancias magnéticas nucleares (NMR) han establecido que muchos de los péptidos AB poseen una estructura secundaria en forma de α-hélice que puede evolucionar a formas más compactas dependiendo del medio donde se encuentre.
Ya que alrededor del 25% de la superficie de estas moléculas tiene un fuerte carácter hidrofóbico, es común observar enrollamientos semi-estables que llevan a conformaciones β-plegadas, que tienen un papel fundamental en los estados de agregación de tales péptidos.
Los efectos neurotóxicos de estas proteínas se asocian tanto a las formas solubles como a los agregados insolubles. La oligomerización ocurre intracelularmente y los conglomerados de mayor tamaño son los elementos más importantes en la formación de placas seniles y ovillos neurofibrilares, importantes marcadores de neuropatologías como la enfermedad de Alzheimer.
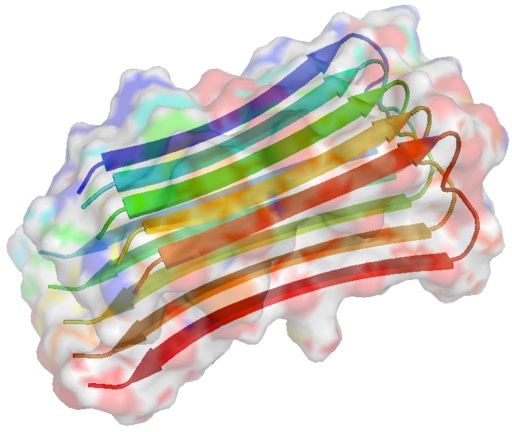
Mutaciones en los genes de la APP, así como en los genes codificantes de las secretasas implicadas en su procesamiento, pueden ocasionar deposiciones masivas del péptido AB que dan lugar a diferentes amiloidopatías, entre ellas la amiloidopatía de Dutch.
Se ha destacado la participación del ABP en la liberación de mediadores de la respuesta inflamatoria y de radicales libres que tienen efectos nocivos en el sistema nervioso central al disparar las cascadas de muerte celular. Ocasiona también el sobrecrecimiento neuronal, induce estrés oxidativo y promueve la activación de las células gliales.
Algunas formas del péptido AB provocan la formación de ácido nítrico y la entrada excesiva de iones calcio a las células al incrementar la expresión de los receptores rianodina en las neuronas, lo que eventualmente termina con la muerte celular.
Su acumulación en los vasos sanguíneos cerebrales se conoce como angiopatía cerebro- amiloide y está caracterizada por causar vasoconstricción y pérdida del tono vascular.
Así pues, en altas concentraciones, además de su neurotoxicidad, la acumulación del ABP debilita el flujo sanguíneo de la estructura cerebral y acelera el mal funcionamiento neuronal.
Ya que la proteína precursora del ABP está codificada en el cromosoma 21, los pacientes con síndrome de Down (que poseen una trisomía en este cromosoma), si alcanzan edades avanzadas, son más propensos a sufrir enfermedades relacionadas con el péptido AB.
- Breydo, L., Kurouski, D., Rasool, S., Milton, S., Wu, J. W., Uversky, V. N., Glabe, C. G. (2016). Structural differences between amyloid beta oligomers. Biochemical and Biophysical Research Communications, 477(4), 700–705.
- Cheignon, C., Tomas, M., Bonnefont-Rousselot, D., Faller, P., Hureau, C., & Collin, F. (2018). Oxidative stress and the amyloid beta peptide in Alzheimer’s disease. Redox Biology, 14, 450–464.
- Chen, G. F., Xu, T. H., Yan, Y., Zhou, Y. R., Jiang, Y., Melcher, K., & Xu, H. E. (2017). Amyloid beta: Structure, biology and structure-based therapeutic development. Acta Pharmacologica Sinica, 38(9), 1205–1235.
- Coria, F., Moreno, A., Rubio, I., García, M., Morato, E., & Mayor, F. (1993). The cellular pathology associated with B-amyloid deposits in non-demented aged individuals. Neuropathology Applied Neurobiology, 19, 261–268.
- Du Yan, S., Chen, X., Fu, J., Chen, M., Zhu, H., Roher, A., … Schmidt, A. (1996). RAGE and amyloid-beta peptide neurotoxicity in Alzheimer’s disease. Nature, 382, 685–691.
- Hamley, I. W. (2012). The Amyloid Beta Peptide : A Chemist’s Perspective Role in Alzheimer’s and Fibrillization. Chemical Reviews, 112(10), 5147–5192.
- Hardy, J., & Higgins, G. (1992). Alzheimer’s Disease : The Amyloid Cascade Hypothesis. Science, 256(5054), 184–185.
- Menéndez, S., Padrón, N., & Llibre, J. (2002). Péptido Beta Amiloide, Proteína TAU y Enfermedad de Alzheimer. Rev Cubana Invest Biomed, 21(4), 253–261.
- Sadigh-Eteghad, S., Sabermarouf, B., Majdi, A., Talebi, M., Farhoudi, M., & Mahmoudi, J. (2014). Amyloid-beta: A crucial factor in Alzheimer’s disease. Medical Principles and Practice, 24(1), 1–10.
- Selkoe, D. J. (2001). Clearing the Brain’s Amyloid Cobwebs. Neuron, 32, 177–180.
- Yao, Z. X., & Papadopoulos, V. (2002). Function of beta-amyloid in cholesterol transport: a lead to neurotoxicity. The FASEB Journal, 16(12), 1677–1679.
