No metales: historia, propiedades, grupos, usos
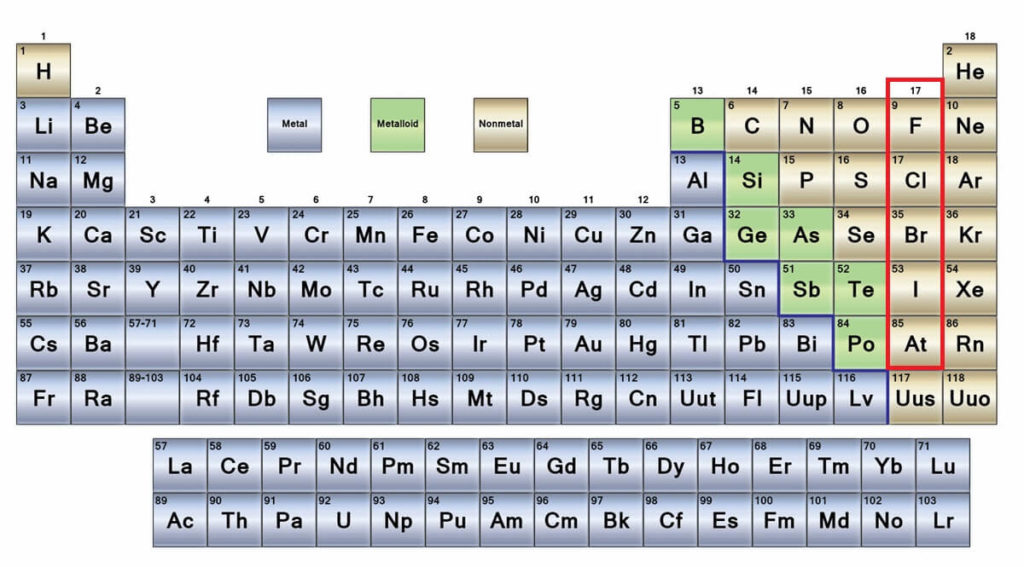
Los no metales son un grupo de elementos que se ubican en el lado derecho de la tabla periódica, a excepción del hidrógeno que se ubica en el grupo 1 (IA), junto con los metales alcalinos. Si se quiere saber cuáles son, hay que dirigir la mirada a la esquina derecha superior del bloque p.
Los átomos de los no metales son relativamente pequeños y su capa electrónica externa presenta un número elevado de electrones. Entre los elementos no metálicos pueden encontrarse sólidos, líquidos y gases; aunque en su mayoría se encuentran en estado gaseoso, varios de ellos enriqueciendo la atmósfera.
Una buena parte de los no metales están presentes en todos los seres vivos en forma de compuestos y de macromoléculas. Por ejemplo: el carbono, el oxígeno y el hidrógeno están presentes en la totalidad de las proteínas, los lípidos, los carbohidratos y los ácidos nucleicos.
El fósforo está presente en todos los ácidos nucleicos y en algunos carbohidratos y lípidos. El azufre se encuentra en muchas proteínas. El nitrógeno forma parte de todos los ácidos nucleicos y proteínas.
Por otro lado, bajo tierra, los gases de metano y los crudos petroleros están compuestos casi en su totalidad de elementos no metálicos. De hecho, los hidrocarburos (carbono e hidrógeno) dan una idea de qué tan abundantes son los no metales pese a su menor número de elementos en la tabla periódica.
Índice del artículo
Desde la antigüedad (3750 a.C.) los egipcios usaban el carbón para reducir el cobre presente en sus minerales, como la corvellita y la malaquita.
En 1669, Hennin Brand logró aislar el fósforo de orinas recolectadas. Henry Cavendish (1776) logró la identificación del hidrógeno, aunque varios investigadores, entre ellos Robert Boyle (1670), produjeron hidrógeno al hacer reaccionar un ácido fuerte con un metal.
Carl Scheele produjo oxígeno al calentar el óxido de mercurio con nitratos (1771). Curtois logró aislar el yodo, mientras trataba de preparar salitre a partir de algas marinas (1811). Balard y Gmelin aislaron el bromo (1825).
En 1868, Janssen y Lockger, en forma independiente, descubrieron el helio mediante la observación de una línea amarilla en el estudio del espectro de la luz solar que no pertenecía a otro elemento. Moissan logró aislar el flúor (1886).
En 1894, Lord Rayleigh y Ramsey descubrieron el argón mediante el estudio de las propiedades del nitrógeno. Ramsay y Travers (1898) aislaron el criptón, neón y xenón del argón líquido, mediante destilación criogénica del aire.

Algunas de las propiedades físicas de los no metales son:
-Tienen baja conductancia eléctrica, a excepción del carbono en forma de grafito, el cual es un buen conductor de la electricidad.
-Pueden presentarse bajo la apariencia física de sólidos, líquidos o gases.
-Tienen baja conductancia térmica, a excepción del carbono bajo la forma de diamante que no se comporta como un aislante térmico.
-Tienen poco lustre, a diferencia del brillo metálico de los metales.
-Los sólidos no metálicos son quebradizos, por lo que no son dúctiles ni maleables.
-Tienen puntos de fusión y ebullición bajos.
-Pueden presentar diferentes estructuras cristalinas. Así el fósforo, el oxígeno y el flúor tienen una estructura cristalina cúbica; el hidrógeno, el carbono y el nitrógeno, hexagonal; y el azufre, el cloro, el bromo y el yodo, ortorrómbica.
Los no metales se caracterizan por tener una alta energía de ionización y un valor alto de electronegatividad. El flúor, por ejemplo, tiene la mayor electronegatividad (3,98), siendo el elemento más reactivo de los no metales.
Pero sorprendentemente, los gases nobles helio (5,5) y neón (4,84) tienen la mayor electronegatividad. Sin embargo, son químicamente inertes por tener llenas las capas electrónicas externas.
Los no metales forman compuestos iónicos con los metales, y covalentes con los no metales.
Los elementos no metálicos se encuentran formando moléculas diatómicas, unidas por enlaces covalentes. Mientras, los átomos de los gases nobles se encuentran en forma de unidades atómicas.
Forman óxidos ácidos que al reaccionar con el agua originan ácidos.
Está constituido por el hidrógeno un gas incoloro e inodoro, diátomico. Estado de oxidación +1. Tiene menor densidad que el aire. En el estado sólido presenta una estructura cristalina hexagonal. El hidrógeno es un elemento poco reactivo.
El carbono es el único no metal perteneciente a este grupo. El carbono bajo la forma de grafito es un sólido lustroso, con una estructura cristalina hexagonal. Tiene una alta conductividad eléctrica. Sus estados de oxidación más comunes son +2 y +4.
Nitrógeno
Gas incoloro e inodoro. Es un elemento poco reactivo y ligeramente más denso que el aire. Estados de oxidación más comunes: -3 y +5. Forma moléculas diatómicas, N2.
Fósforo
Sólido, su color puede ser blanco, amarillo o negro. Poco reactivo. Estructura cristalina ortorrómbica. Electronegatividad 2,1. Estados de oxidación más comunes: -3 y +5.
Oxígeno
Gas incoloro o azul pálido, inodoro. Generalmente no reactivo. Estructura cristalina cúbica. Es un aislante y un agente oxidante fuerte. Electronegatividad 3,5. Estado de oxidación -2
Azufre
Sólido de color amarillo brillante, quebradizo, moderadamente reactivo. Estructura cristalina ortorrómbica. Forma enlaces covalentes. Electronegatividad 2,5. Estados de oxidación más comunes: -2, +2, +4, y +6.
Selenio
Sólido de color gris o rojizo a negro. El selenio gris muestra una conductividad eléctrica sensible a la luz. Es un sólido blando y quebradizo. Electronegatividad 2,4. Estados de oxidación: -2, +2, +4 y +6.
Flúor
Es un gas de color amarillo pálido, muy tóxico. Es un elemento muy reactivo. Se presenta como moléculas diatómicas, F2. En estado sólido cristaliza en forma cúbica. Electronegatividad 3,98. Estados de oxidación -1.
Cloro
Es un gas de color verde-amarillo. Presenta moléculas diatómicas, Cl2. Es muy reactivo. En estado sólido la estructura cristalina es ortorrómbica. Electronegatividad 3,0. Estados de oxidación: – 1, +1, +3, +5, +7.
Bromo
Es un líquido rojo-café. Electronegatividad 2,8. Estados de oxidación -1, +1, +3, +5 y +7.
Yodo
Es un sólido de color negro que cuando se sublima emite un vapor violeta. Estructura cristalina ortorrómbica. Los yoduros metálicos son iónicos. Electronegatividad 2,5. Estados de oxidación: -1, +1, +3, +5, y +7.
Astato
Es un sólido negro. Estructura cristalina cúbica centrada en la cara. Electronegatividad 2,2. Es un agente oxidante débil.
Helio
Tiene una conductividad térmica alta. Electronegatividad 5,5. Es químicamente inerte y no inflamable. Baja densidad y alta fluidez.
Neón
Alta capacidad de refrigeración en estado líquido. Electronegatividad 4,84. Es el menos reactivo de los gases nobles.
Argón
Es más denso que el aire. Químicamente inerte. Electronegatividad 3,2.
Criptón
Electronegatividad 2,94. Puede reaccionar con el flúor para formar difluoruro de criptón (KrF2).
Xenón
Atraviesa la barrera hematoencefálica. Responde a la corriente eléctrica produciendo luz. Electronegatividad 2,2. Forma complejos con el flúor, el oro y el oxígeno.
Radón
Es un elemento radiactivo. Electronegatividad 2,06. Forma compuestos con el flúor (RnF2) y con el oxígeno (RnO3).

Se utiliza en la propulsión de cohetes y como combustible en los motores de automóviles que usan hidrógeno. Se emplea en la síntesis de amoníaco (NH3) y en la hidrogenación de las grasas.
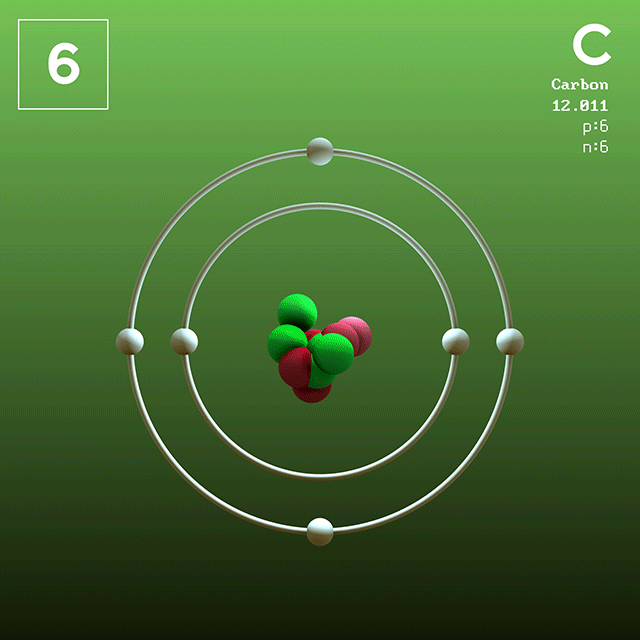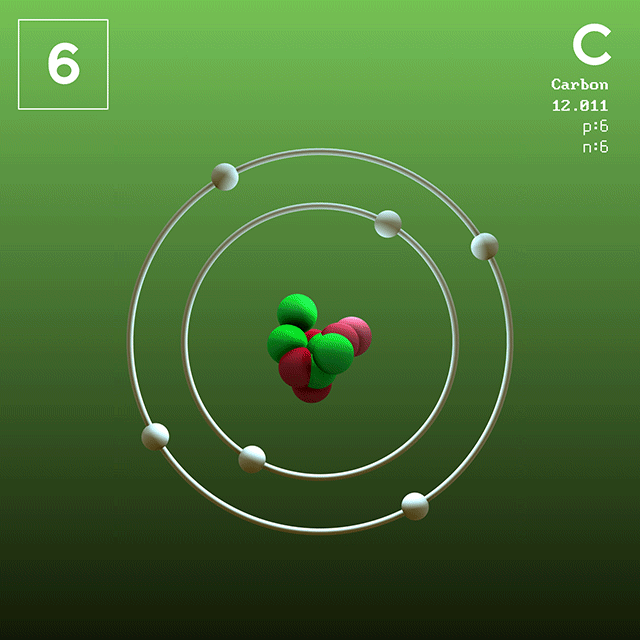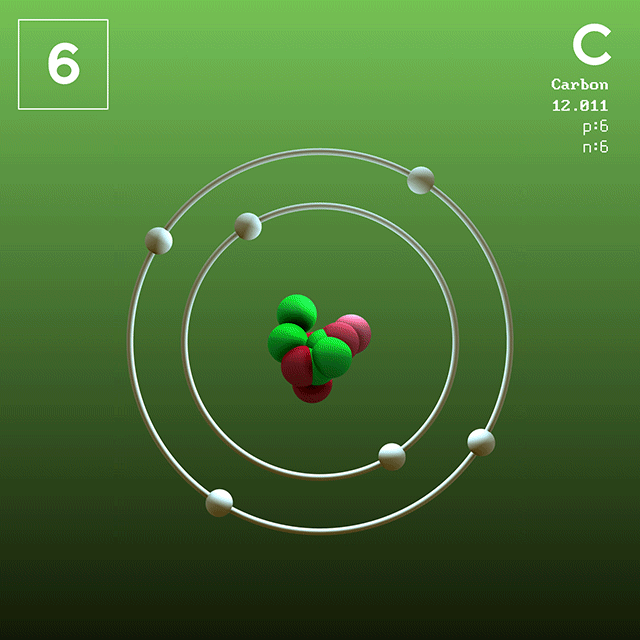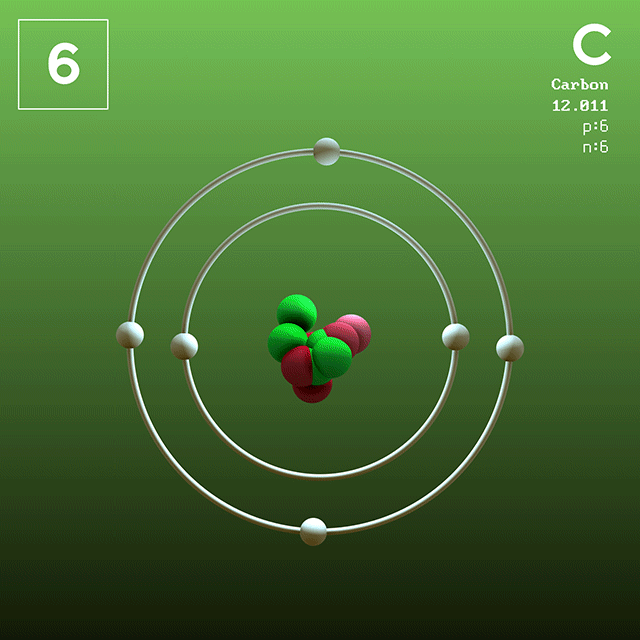
El grafito se utiliza en la fabricación de lápices y de fibras de gran resistencia que se usan en la elaboración de artículos deportivos. El diamante se usa como una joya de gran valor y en los taladros de perforación como abrasivo. El dióxido de carbono se emplea en la elaboración de bebidas gaseosas.
Se emplea en la producción de amoníaco, ácido nítrico y urea. El nitrógeno es un elemento esencial para las plantas y se usa en la fabricación de fertilizantes.
El fósforo blanco se utiliza como raticida, insecticida y en la industria pirotécnica. El fósforo rojo se emplea en la fabricación de cerillas. También se usan sus compuestos en elaboración de fertilizantes.
El oxígeno se emplea en la elaboración de acero, plásticos y textiles. También se usa en los propulsores de cohetes, oxigenoterapia y asistencia para la respiración en aeronaves, submarinos y vuelos espaciales.
Se utiliza como materia prima para la producción de ácido sulfúrico, pólvora y en la vulcanización de los cauchos. Los sulfitos se usan para blanquear el papel y en fungicida.
Se usa para impartir una coloración rojo escarlata al vidrio. También se emplea para neutralizar el matiz verdoso producido por contaminación del vidrio con compuestos del hierro. Se utiliza en células fotoeléctricas con aplicación en puertas y ascensores.

Se añade a las cremas dentales para prevenir las caries. El fluoruro de hidrógeno se usa como materia prima para el teflón. El flúor monoatómico se usa en la fabricación de semiconductores.
Se usa en la metalurgia extractiva y en la cloración de hidrocarburos para la fabricación de productos diversos como el PVC. El cloro se usa en blanqueadores de pulpa de madera y textiles. Se emplea también como desinfectante de agua.
Se emplea en la preparación de bromuro de plata para lentes sensibles a la luz y en películas fotográficas También se utiliza en la elaboración del sedante bromuro de sodio y dibrometano, un componente antidetonante de la gasolina.
Se agrega yoduro de potasio (KI) para prevenir el bocio tiroideo. La tintura de yodo es utilizada como antiséptico y germicida. El yodo forma parte de las hormonas tiroideas.
Se usa en el llenado de globos aerostáticos y mezclado con oxígeno para la respiración en aguas profundas. Se utiliza para las soldaduras en una atmósfera inerte, y ayuda a mantener además temperaturas muy bajas en investigación.
En tubos de vidrios que se iluminan por la acción de la electricidad (luces rojas de neón).
Se usa para crear una atmósfera para soldar y en el llenado de los focos de incandescencia.
Se utiliza una mezcla de xenón y criptón en la producción de destellos de gran intensidad en la exposición fotográfica de corta duración.
Se utiliza en el tratamiento de tumores cancerosos por radioterapia.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. y Ahern, K. G. (2002). Bioquímica. Tercera Edición. Edit. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06 de octubre de 2019). What Are the Properties of Nonmetals? Recuperado de: thoughtco.com
- Wikipedia. (2019). Nonmetal. Recuperado de: en.wikipedia.org
- The Editors of Encyclopaedia Britannica. (05 de abril de 2016). Nonmetal. Encyclopædia Britannica. Recuperado de:britannica.com
- José M. Gavira Vallejo. (27 de enero de 2016). ¿Cuáles son los elementos pnicógenos? ¿Y los icoságenos, los cristalógenos, los calcógenos…? Recuperado de: triplenlace.com
