Alcohol secundario: estructura, propiedades, nomenclatura, usos
Un alcohol secundario tiene el carbono portador del grupo hidroxilo (OH), unido a dos carbonos. Mientras, en el alcohol primario el carbono portador del grupo hidroxilo está unido a un átomo de carbono, y en el alcohol terciario unido a tres átomos de carbonos.
Los alcoholes son ácidos ligeramente más débiles que el agua, con los pKa siguientes: agua (15,7); alcoholes metílico (15,2), etílico (16), isopropílico (alcohol secundario, 17), y terbutílico (18). Como puede verse, el alcohol isopropílico es menos ácido que los alcoholes metílico y etílico.
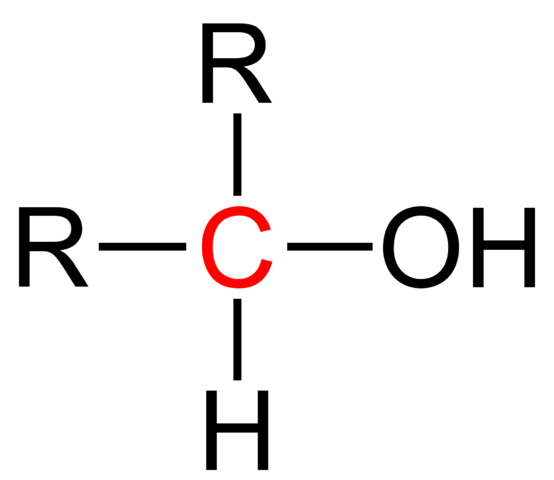
En la imagen superior se muestra la fórmula estructural para un alcohol secundario. El carbono en rojo es el portador del OH, y está enlazado a dos grupos alquilo (o arilo) R y a un único átomo de hidrógeno.
Todos los alcoholes tienen la fórmula genérica ROH; pero si se observa en detalle al carbono portador, entonces se obtienen los alcoholes primarios (RCH2OH), secundarios (R2CHOH, aquí planteados), y terciarios (R3COH). Este hecho marca una diferencia en sus propiedades físicas y reactividad.
Índice del artículo
Las estructuras de los alcoholes dependen de la naturaleza de los grupos R. No obstante, para los alcoholes secundarios se puede hacer cierta ejemplificación, considerando que solo puede haber estructuras lineales con o sin ramificaciones, o estructuras cíclicas. Por ejemplo, se tiene la siguiente imagen:
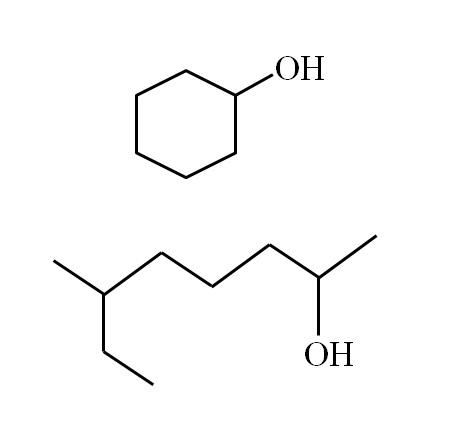
Nótese que para ambas estructuras hay algo en común: el OH está enlazado a una “V”. Cada extremo de la V representa un grupo R igual (parte superior de la imagen, estructura cíclica) o distinto (parte inferior, cadena ramificada).
De esta manera se identifica muy fácilmente cualquier alcohol secundario, aun si se desconoce su nomenclatura en absoluto.
Las propiedades de los alcoholes secundarios físicamente no difieren demasiado de otros alcoholes. Suelen ser líquidos transparentes, y para ser un sólido a temperatura ambiente necesita formar varios puentes de hidrógeno y tener masa molecular alta.
No obstante, la misma fórmula estructural R2CHOH deja entrever ciertas propiedades únicas en general para estos alcoholes. Por ejemplo, el grupo OH se encuentra menos expuesto y disponible para las interacciones por puentes de hidrógeno, R2CH-OH—OHCHR2.
Esto se debe a que los grupos R, adyacentes al carbono portador del OH, pueden interponerse y dificultar la formación de los puentes de hidrógeno. Como resultado, los alcoholes secundarios tienen puntos de ebullición más bajos que los primarios (RCH2OH).
De acuerdo a la definición de Brönsted-Lowry, un ácido es aquel que dona protones o iones hidrógeno, H+. Cuando esto sucede con un alcohol secundario, se tiene:
R2CHOH + B– => R2CHO– + HB
La base conjugada R2CHO–, anión alcóxido, debe estabilizar su carga negativa. Para el alcohol secundario, la estabilización es menor ya que los dos grupos R poseen densidad electrónica, la cual repele en cierto grado la carga negativa sobre el átomo de oxígeno.
Mientras, para el anión alcóxido de un alcohol primario, RCH2O–, hay menor repulsión electrónica al haber solo un grupo R y no dos. Además, los átomos de hidrógeno no ejercen una repulsión significativa, y por el contrario, contribuyen a estabilizar la carga negativa.
Por lo tanto, los alcoholes secundarios son menos ácidos que los alcoholes primarios. Si esto es así, entonces son más básicos, y justamente por las mismas razones:
R2CHOH + H2B+ => R2CHOH2+ + HB
Ahora, los grupos R estabilizan la carga positiva en el oxígeno cediendo parte de su densidad electrónica.
Halogenuro de hidrógeno y trihalogenuro de fósforo
Un alcohol secundario puede reaccionar con un halogenuro de hidrógeno. Se muestra la ecuación química de la reacción entre el alcohol isopropílico y el ácido bromhídrico, en un medio de ácido sulfúrico, y produciendo bromuro de isopropilo:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + H2O
Y también puede reaccionar con un trihalogenuero de fósforo, PX3 (X=Br, I):
CH3-CHOH-CH2-CH2-CH3 + PBr3 => CH3-CHBr-CH2-CH2-CH3 + H3PO3
La ecuación química de arriba corresponde a la reacción entre el Sec-pentanol y el tribromuro de fósforo, originando bromuro de sec-pentilo.
Nótese que en ambas reacciones se produce un halogenuro de alquilo secundario (R2CHX).
Deshidratación
En esta reacción se pierde un H y un OH de carbonos vecinos, formándose un doble enlace entre estos dos átomos de carbono. Por lo tanto, hay la formación de un alqueno. La reacción requiere de un catalizador ácido y el suministro de calor.
Alcohol => Alqueno + H2O
Se tiene por ejemplo la siguiente reacción:
Ciclohexanol => Ciclohexeno + H2O
Reacción con metales activos
Los alcoholes secundarios pueden reaccionar con los metales:
CH3-CHOH-CH3 + K => CH3CHO–K+CH3 + ½ H+
Aquí el alcohol isopropílico reacciona con el potasio para formar la sal isopróxido de potasio e iones hidrógeno.
Esterificación
El alcohol secundario reacciona con un ácido carboxílico para originar un éster. Por ejemplo, se muestra la ecuación química de la reacción del alcohol sec-butílico con el ácido acético, para producir acetato de sec-butilo:
CH3CHOHCH2CH3 + CH3COOH => CH3COOCHCH3CH2CH3
Oxidación
Los alcoholes primarios se oxidan a aldehídos, y estos a su vez se oxidan a ácidos carboxílicos. Pero, los alcoholes secundarios se oxidan a acetona. Las reacciones son usualmente catalizadas por dicromato de potasio (K2CrO7) y el ácido crómico (H2CrO4).
La reacción global es:
R2CHOH => R2C=O
Los alcoholes secundarios se nombran señalando la posición del grupo OH en la cadena principal (más larga). Este número antecede el nombre, o puede ir después del nombre del alcano respectivo para dicha cadena.
Por ejemplo, el CH3CH2CH2CH2CHOHCH3, es el 2-hexanol o hexan-2-ol.
Si la estructura es cíclica, no hay necesidad de colocar un numerador; a menos, que haya otros sustituyentes. Por eso el alcohol cíclico de la segunda imagen se llama ciclohexanol (el anillo es hexagonal).
Y para el otro alcohol de la misma imagen (el ramificado), su nombre es: 6-etil-heptan-2-ol.
-El sec-butanol se usa como disolvente y producto químico intermedio. Está presente en los fluidos hidráulico para frenos, limpiadores industriales, abrillantadores, decapantes de pinturas, agentes de flotación de minerales, y esencias de frutas y perfumes.
-El alcohol isopropanol se utiliza como disolvente industrial y como anticoagulante. Se emplea en aceites y en tintas de secado rápido, como antiséptico y sustituto del etanol en cosméticos (por ejemplo: lociones para la piel, tónicos capilares y alcohol para fricciones).
-El isopropanol es un ingrediente de jabones líquidos, limpiadores de cristales, aromatizantes sintéticos de bebidas no alcohólicas y alimentos. Además, es un producto químico intermedio.
-El ciclohexanol se emplea como disolvente, en el acabado de tejidos, en el procesamiento del cuero y emulsionante de jabones, y detergentes sintéticos.
-El metilciclohexanol es un ingrediente de productos quitamanchas a base de jabón y en detergentes para tejidos especiales.
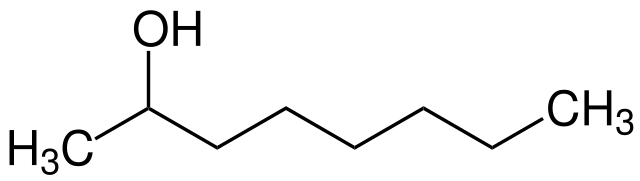
Es un alcohol graso. Es un líquido incoloro, poco soluble en agua, pero soluble en la mayoría de los solventes no polares. Se utiliza, entre otros usos, en la elaboración de sabores y fragancias, pinturas y recubrimientos, tintas, adhesivos, cuidados del hogar y lubricantes.
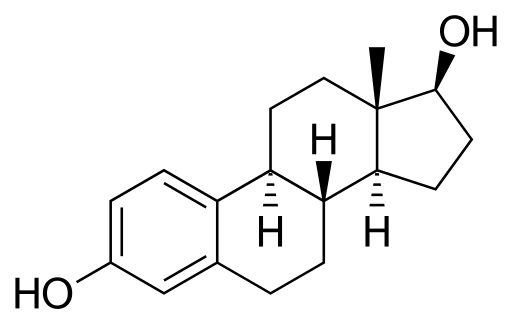
Es una hormona sexual esteroidea. Tiene dos grupos hidroxilos en su estructura. Es el estrógeno predominante durante los años reproductivos.
Es un metabolito que probablemente se origina de la oxidación del lípido de leucotrieno. Se clasifica como un cistinil leucotrieno. Estos compuestos son mediadores del proceso inflamatorio que contribuye a las características fisiopatológicas de la rinitis alérgica.
Es un alcohol que se encuentra en las frutas. Además, se encuentra en el aceite de jengibre y en las fresas. Es transparente, incoloro e insoluble en agua. Se emplea como disolvente de varias resinas e interviene en la fase de flotación en procesamiento de minerales.
- James. (17 de septiembre de 2014). Alcohols (1) – Nomenclature and Properties. Recuperado de: masterorganicchemistry.com
- Enciclopedia de Salud y Seguridad en el Trabajo. (s.f.). Alcoholes. [PDF]. Recuperado de: insht.es
- Clark J. (16 de julio de 2015). Structure and Classification of Alcohols. Chemistry Libretexts. Recuperado de: chem.libretexts.org
- PubChem. (2019). 20-Hydroxy-leukotriene E4. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Wikipedia. (2018). 2-Octanol. Recuperado de: en.wikipedia.org
