Destilación simple: proceso y ejemplos
La destilación simple es un procedimiento en el que los vapores producidos de un líquido son llevados directamente a un condensador, dentro del cual baja la temperatura de los vapores y se produce su condensación.
Se usa para separar un componente volátil de los componentes no volátiles presentes en un líquido. También se usa para la separación de dos líquidos presentes en una disolución con puntos de ebullición muy diferentes.
La destilación simple no es un método eficiente para la separación de dos líquidos volátiles presentes en una disolución. Cuando la temperatura de ella aumenta mediante el suministro de calor, la energía cinética de las moléculas aumenta también, lo que les permite vencer la fuerza de cohesión entre ellas.
Los líquidos volátiles comienzan a hervir cuando su presión de vapor iguala a la presión exterior ejercida sobre la superficie de la disolución. Ambos líquidos contribuyen a la composición del vapor formado, siendo mayor la presencia del líquido más volátil; es decir, el de menor punto de ebullición.
Por lo tanto, el líquido más volátil compone la mayor parte del destilado formado. El proceso se repite hasta alcanzar una pureza deseada o la máxima concentración posible.
Índice del artículo
En la destilación simple se aumenta la temperatura de una disolución hasta alcanzar su ebullición. En ese instante ocurre la transición entre los estados líquido a gaseoso. Esto se observa cuando comienza un burbujeo constante en la disolución.
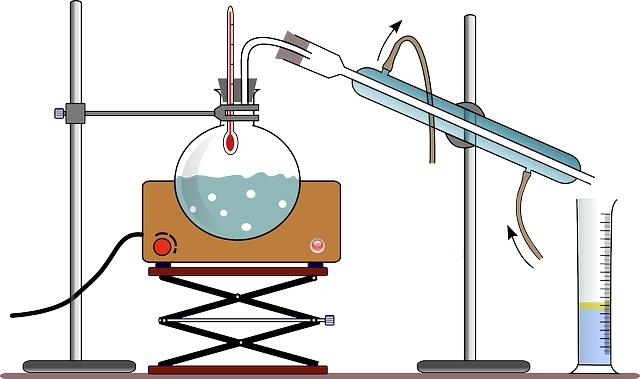
El equipo para realizar la destilación simple consta, usualmente, de un mechero o de una manta de calentamiento (ver imagen); un matraz redondo de vidrio refractario con una boca de vidrio esmerilado, para permitir su acoplamiento; y unas perlitas de vidrio (algunos usan un palito de madera) para reducir el tamaño de las burbujas formadas.
Las perlitas de vidrio sirven como núcleos formadores de burbujas, que permiten que el líquido hierva lentamente, evitando un sobrecalentamiento que se traduce en la formación de una especie de burbujas gigantes; capaces incluso de expulsar una masa de líquido fuera del balón de destilación.
Acoplado a la boca del matraz, se coloca un adaptador de vidrio refractario con tres bocas, las cuales están hechas de vidrio esmerilado. Una boca se acopla al matraz de destilación, una segunda boca se acopla al condensador y la tercera boca es cerrada mediante el uso de un tapón de goma.
En la imagen, el montaje carece de este adaptador; y en su lugar, a través del mismo tapón de goma se colocan el termómetro y un conector directo al condensador.
El condensador es un dispositivo diseñado para cumplir con la función que indica su nombre: condensar el vapor que se desplaza por su interior. Por su boca superior está acoplado al adaptador, y por su boca inferior está conectado a un balón donde se recogen los productos de la destilación.
En el caso de la imagen, usan (aunque no es siempre correcto) un cilindro graduado, para medir de una vez el volumen destilado.
El agua que circula por la camisa exterior del condensador, ingresa a esta por su parte inferior y sale por la parte superior. Esto garantiza que la temperatura del condensador sea lo suficientemente baja para permitir la condensación de los vapores producidos en el matraz de destilación.
Todas las piezas que forman el aparato de destilación están fijadas por pinzas conectadas a un soporte metálico.
Un volumen de la disolución que va a ser sometida a la destilación es colocado en el matraz redondo con una capacidad adecuada.
Se hacen las conexiones debidas empleando grafito o grasa para garantizar que el sellado sea eficiente, y se inicia el calentamiento de la disolución. Simultáneamente se comienza el paso de agua a través del condensador.
A medida que transcurre el calentamiento del balón de destilación, se observa en el termómetro un incremento de la temperatura, hasta alcanzar un punto en el cual la temperatura permanece constante. Esto permanece así aunque se continúe con el calentamiento; a menos que todo el líquido volátil se haya evaporado por completo.
La explicación para este comportamiento es que se ha alcanzado el punto de ebullición del componente de menor punto de ebullición de la mezcla de líquidos, en el cual su presión de vapor iguala a la presión exterior (760 mm de Hg).
En este punto, toda la energía calórica se gasta en el cambio del estado líquido al estado gaseoso que involucra el vencimiento de la fuerza de cohesión intermolecular del líquido. Por lo tanto, el suministro de calor no se traduce en un aumento de la temperatura.
El líquido producto de la destilación se recoge en matraces, debidamente rotulados, cuyos volúmenes dependerá del volumen originalmente colocado en el matraz de destilación.
Se tiene una solución de alcohol en agua del 50%. Sabiendo que el punto de ebullición del alcohol es de 78,4 ºC y el punto de ebullición del agua es 100°C aproximadamente, ¿se puede obtener entonces un alcohol puro con un paso de destilación simple? La respuesta es no.
Al calentar la mezcla alcohol-agua, se alcanza inicialmente el punto de ebullición del líquido más volátil; en este caso, el alcohol. El vapor formado tendrá una mayor proporción del alcohol, pero también habrá la presencia alta de agua en el vapor, por ser semejantes los puntos de ebullición.
El líquido recogido de la destilación y condensación tendrá un porcentaje de alcohol mayor al 50%. Si este líquido se somete a destilaciones sucesivas, se puede alcanzar una solución de alcohol concentrada; pero no pura, ya que los vapores continuarán arrastrando agua a cierta composición, formando lo que se conoce como un azeótropo
El líquido producto de la fermentación de azúcares tiene un porcentaje de alcohol del 10%. Esta concentración que puede llevarse a 50%, como en el caso del Whisky, mediante destilación simple.
Una disolución de una sal en agua está formada por un líquido que puede ser volatizado, y un compuesto no volátil, con un punto de ebullición alto: la sal.
Al destilar la disolución se podrá obtener agua pura en el líquido de condensación. Mientras, en el fondo del matraz de destilación las sales sedimentarán.
Se tiene una mezcla de alcohol etílico, con un punto de ebullición de 78,4 ºC, y glicerina, con un punto de ebullición de 260 ºC. Cuando se somete a destilación simple, el vapor formado tendrá un porcentaje muy alto de alcohol, cercano al 100%.
Por lo que se obtendrá un líquido destilado con un porcentaje de alcohol, semejante al del vapor. Esto sucede porque los puntos de ebullición de los líquidos son muy diferentes.
- Claude Yoder. (2019). Distillation. Wired Chemistry. Recuperado de: wiredchemist.com
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Dragani, Rachelle. (17 de mayo de 2018). Three Examples of Simple Distillation Mixtures. Sciencing. Recuperado de: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (02 de enero de 2019). What Is Distillation? Chemistry Definition. Recuperado de: thoughtco.com
- Dr Welder. (s.f.). Simple Distillation. Recuperado de: dartmouth.edu
- Universidad de Barcelona. (s.f.). Destilación. Recuperado de: ub.edu
