Carbono: propiedades, estructura, obtención, usos
El carbono es un elemento químico no metálico cuyo símbolo químico es C. Se debe su nombre al carbón, vegetal o mineral, en donde sus átomos definen variadas estructuras. Muchos autores lo califican como el Rey de los elementos, pues forma una amplia gama de compuestos orgánicos e inorgánicos, y se presenta además en un considerable número de alótropos.
Y si esto no es suficiente para referirse a él como un elemento especial, se halla en todos los seres vivos; todas sus biomoléculas deben su existencia a la estabilidad y fuerza de los enlaces C-C y su alta tendencia a concatenarse. El carbono es el elemento de la vida, y con sus átomos se construyen sus cuerpos.

Los compuestos orgánicos con los que se construyen los biomateriales consisten prácticamente de esqueletos carbonados y heteroátomos. Estos pueden apreciarse a simple vista en la madera de los árboles; y también, cuando un rayo cae sobre ellos y los rostiza. El sólido negro inerte remanente también posee carbono; pero se trata de carbón vegetal.
Es así pues que existen manifestaciones “muertas” de este elemento: el carbón vegetal, producto de las combustiones en ambientes pobres en oxígeno; y el carbón mineral, producto de procesos geológicos. Ambos sólidos se parecen, son negros y arden para generar calor y energía; aunque con rendimientos diferentes.
Desde este punto el carbono es el quinceavo elemento más abundante de la corteza terrestre. No se extraña cuando se produce anualmente millones de toneladas de carbón mineral. Estos minerales difieren en sus propiedades en función del grado de impurezas, ubicándose la antracita como el de carbón mineral de mayor calidad.
La corteza terrestre no solo es rica en carbón mineral, sino también en carbonatos, especialmente piedra caliza y dolomitas. Y respecto al Universo, es el cuarto elemento más abundante; es decir, hay más carbono allá afuera en otros planetas.
Índice del artículo
- 1 Historia del carbono
- 2 Propiedades
- 3 Estructura y configuración electrónica
- 4 Obtención
- 5 Usos
- 6 Riesgos y precauciones
- 7 Referencias
El carbono quizás sea tan viejo como la propia corteza terrestre. Desde tiempos inmemoriales civilizaciones antiguas se han topado con este elemento en sus múltiples presentaciones naturales: hollín, carbón, carbón vegetal o de leña, diamantes, grafito, alquitrán de hulla, antracita, etc.
Todos aquellos sólidos, si bien compartían las tonalidades obscuras (a excepción del diamante), el resto de sus propiedades físicas, así como su composición, diferían notablemente. Por aquel entonces era imposible aclamar que en esencia consistían de átomos de carbono.
Fue así que a lo largo de la historia el carbón se clasificó en función de su calidad al momento de arder y brindar calor. Y con los gases formados por su combustión se calentó masas de aguas, que a su vez, produjeron vapores que movieron turbinas generadoras de corrientes eléctricas.
El carbono de manera insospechada estaba presente en el carbón vegetal producto de la quema de árboles en espacios cerrados o herméticos; en el grafito con que se hicieron los lápices; en los diamantes utilizados como gemas; era el responsable de las durezas del acero.
Su historia va de la mano con la madera, la pólvora, los gases de iluminación citadinos, los trenes y barcos, la cerveza, los lubricantes y otros objetos indispensables para el avance de la humanidad.
¿En qué momento los científicos pudieron asociar los alótropos y minerales del carbono a un mismo elemento? El carbón era visto como un mineral, y no se pensaba en él como un elemento químico digno de ocupar la tabla periódica. El primer paso debió ser demostrar que todos esos sólidos se transformaban en un mismo gas: el dióxido de carbono, CO2.
Antoine Lavoisier en 1772, utilizando armazón de madera con grandes lentes, focalizó los rayos del sol en muestras de carbón vegetal y un diamante. Descubrió que no ninguno de los dos formaba vapores de agua sino CO2. Lo mismo hizo con el hollín y obtuvo los mismos resultados.
Carl Wilhelm Scheele en 1779, encontró la relación química entre el carbón vegetal y el grafito; es decir, ambos sólidos estaban compuestos de los mismos átomos.
Smithson Tennant y William Hyde Wollaston en 1797 comprobaron de manera metodológica (mediante reacciones) que el diamante efectivamente se componía de carbono al producir CO2 en su combustión.
Con estos resultados pronto se arrojó luz sobre el grafito y el diamante, sólidos formados por carbono, y por lo tanto, de elevadas purezas; a diferencia de los sólidos impuros de carbón y otros minerales carbonáceos.
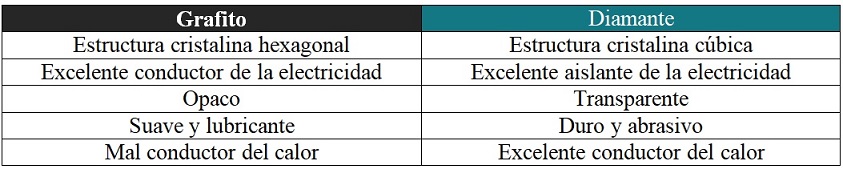
Las propiedades físicas o químicas halladas en los sólidos, minerales o materiales carbonáceos están sujetas a muchas variables. Entre ellas están: la composición o grado de impurezas, las hibridaciones de los átomos de carbono, la diversidad de las estructuras, y la morfología o tamaño de los poros.
Cuando se describen las propiedades del carbono la mayoría de los textos o fuentes bibliográficas se basan en el grafito y el diamante.
¿Por qué? Porque son los alótropos más conocidos para este elemento y representan sólidos o materiales de alta pureza; es decir, prácticamente están hechos nada más que de átomos de carbono (aunque con distintas estructuras, como se explicará en el siguiente apartado).
Las propiedades del carbón vegetal y del carbón mineral difieren en sus orígenes o composiciones, respectivamente. Por ejemplo, el lignito (pobre en carbono) como combustible gatea en comparación a la antracita (rica en carbono). Y qué decir de los otros alótropos: nanotubos, fullerenos, grafenos, grafinos, etc.
Sin embargo, químicamente tienen un punto en común: se oxidan con un exceso de oxígeno en CO2:
C + O2 => CO2
Ahora bien, la velocidad o temperatura que requieren para oxidarse son propias para cada uno de estos alótropos.
Aquí se hará también un breve comentario respecto a las propiedades tan diferentes para estos dos alótropos:
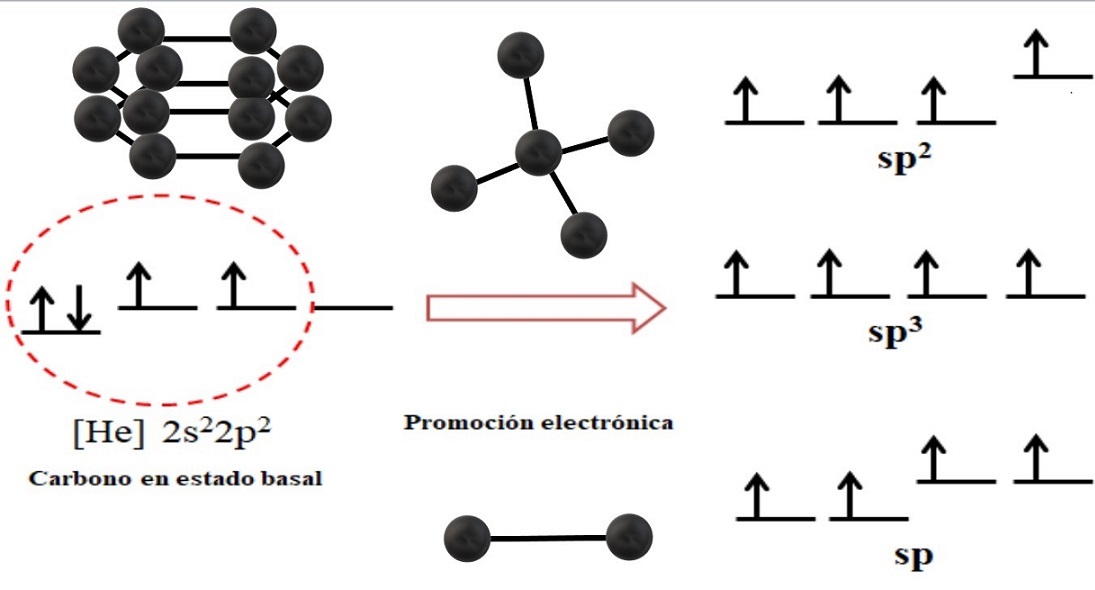
La configuración electrónica para el átomo de carbono es 1s22s22p2, también escrita como [He]2s22p2 (imagen superior). Esta representación corresponde a su estado basal: el átomo de carbono aislado y suspendido en un vacío tal que no puede interactuar con otros.
Se aprecia que uno de sus orbitales 2p carece de electrones, el cual acepta mediante la promoción electrónica un electrón del orbital 2s de menor energía; y así, el átomo adquiere la capacidad de formar hasta cuatro enlaces covalentes a través de sus cuatro orbitales híbridos sp3.
Nótese que los cuatro orbitales sp3 están degenerados en energía (alineados en el mismo nivel). Los orbitales p puros son más energéticos, razón por la que se sitúan por encima de los otros orbitales híbridos (a la derecha de la imagen).
Si hay tres orbitales híbridos, es porque resta un orbital p sin hibridizarse; por lo tanto, se tratan de tres orbitales sp2. Y cuando hay dos de estos orbitales híbridos, dos orbitales p están disponibles para formar dobles o triples enlaces, siendo la hibridación del carbono sp.
Tales aspectos electrónicos son imprescindibles para comprender por qué el carbono puede hallarse en infinidades de alótropos.
Antes de proseguir con las estructuras no está demás mencionar que, dada la configuración electrónica de valencia 2s22p2, el carbono puede tener los siguientes números de oxidación: +4, +2, 0, -2 y -4.
¿Por qué? Estos números corresponden a la suposición de que exista un enlace iónico tal que formes los iones con las cargas respectivas; es decir, C4+, C2+, C0 (neutro), C2- y C4-.
Para que el carbono tenga un número de oxidación positivo debe perder electrones; y para hacerlo, necesariamente tiene que estar enlazado a átomos muy electronegativos (como el oxígeno).
Mientras, para que el carbono tenga un número de oxidación negativo, debe ganar electrones enlazándose a átomos metálicos o menos electronegativos que él (como el hidrógeno).
El primer número de oxidación, +4, significa que el carbono ha perdido todos los electrones de valencia; se quedan vacíos los orbitales 2s y 2p. Si el orbital 2p pierde sus dos electrones, el carbono tendrá número de oxidación de +2; si gana dos electrones, tendrá -2; y si gana dos electrones más completando su octeto de valencia, -4.
Ejemplos
Por ejemplo, para el CO2 el número de oxidación del carbono es +4 (porque el oxígeno es más electronegativo); mientras que para el CH4, es de -4 (porque el hidrógeno es menos electronegativo).
Para el CH3OH, el número de oxidación del carbono es -2 (+1 para los H y -2 para el O); mientras que para el HCOOH, es de +2 (compruebe que la suma dé 0).
Otros estados de oxidación, como el -3 y +3, también son probables, en especial cuando se trata de moléculas orgánicas; por ejemplo, en los grupos metilos, -CH3.
En la imagen superior no solo se mostraron la hibridación de los orbitales para el átomo de carbono, sino además las geometrías moleculares resultantes cuando se enlazan varios átomos (esferas negras) a uno central. Este átomo central para disponer en el espacio un entorno geométrico determinado, debe poseer la respectiva hibridación química que se lo permita.
Por ejemplo, para el tetraedro el carbono central tiene hibridación sp3; porque tal es el arreglo más estable para los cuatro orbitales híbridos sp3. En el caso de los carbonos sp2, pueden formar dobles enlaces y disponer un entorno plano trigonal; y así, estos triángulos definen un hexágono perfecto. Y para una hibridación sp, los carbonos adoptan una geometría lineal.
Así, las geometrías observadas en las estructuras de todos los alótropos se rigen simplemente en tetraedros (sp3), hexágonos o pentágonos (sp2), y líneas (sp).
Los tetraedros definen una estructura 3D, mientras que los hexágonos, pentágonos y líneas, estructuras 3D o 2D; estas últimas vienen a ser los planos o láminas similares a las paredes de los panales de abeja:

Y si plegamos dicha pared hexagonal (pentagonal o mixta), obtendremos un tubo (nanotubos) o un balón (fullerenos), u otra figura. Las interacciones entre estas figuras dan lugar a diferentes morfologías.
Dejando a un lado las geometrías, hibridaciones, o morfologías de las estructuras posibles del carbono, sus sólidos pueden clasificar globalmente en dos tipos: amorfos o cristalinos. Y entre estas dos clasificaciones se reparten sus alótropos.
El carbono amorfo es simplemente aquel que presenta una mezcla arbitraria de tetraedros, hexágonos o líneas, incapaz de establecer un patrón estructural; tal es el caso de la hulla, el carbón vegetal o activado, coque, hollín, etc.
Mientras que el carbono cristalino consta de patrones estructurales conformados por cualquiera de las geometrías planteadas; por ejemplo, el diamante (red tridimensional de tetraedros) y el grafito (láminas hexagonales apiladas).
El carbono puede hallarse puro como grafito o diamante. Estos se hallan en sus respectivos depósitos mineralógicos, diseminados a lo largo del globo terráqueo y en distintos países. Por eso algunas naciones son más exportadoras de uno de estos minerales que otras. En resumidas cuentas “hay que excavar la tierra” para obtener el carbono.
Lo mismo aplica para el carbón mineral y sus tipos. Pero no sucede así con el carbón vegetal, ya que un cuerpo rico en carbono debe “perecer” primero, ya sea bajo el fuego, o un rayo eléctrico; por supuesto, en ausencia de oxígeno, porque de lo contrario se liberaría CO2.
Un bosque entero es una fuente de carbono como carbón vegetal; no solo por sus árboles, sino también por sus faunas.
En general, las muestras que poseen carbono deben someterse a pirolisis (arder en ausencia de oxígeno) para que libere parte de las impurezas como gases; y así, quede como residuo un sólido rico en carbono (amorfo o cristalino).
Nuevamente, al igual que las propiedades y estructura, los usos o aplicaciones van acorde con los alótropos o formas mineralógicas del carbono. Sin embargo, existen ciertas generalidades que sí pueden mencionarse, además de algunos puntos altamente conocidos. Tales son:
-El carbono se ha utilizado desde hace mucho tiempo atrás como agente reductor de minerales en la obtención de los metales puros; por ejemplo, el hierro, silicio y fósforo, entre otros.
-Es la piedra angular de la vida, y la química orgánica y la bioquímica son los estudios de este reflejo.
-También ha sido un combustible fósil que permitió que las primeras máquinas dieran marcha a sus engranajes. Del mismo modo, de él se obtuvo el gas de carbono para los viejos sistemas de iluminación. El carbón fue sinónimo de luz, calor y energía.
-Mezclado como aditivo con el hierro en distintas proporciones permitió la invención y perfeccionamiento de los aceros.
-Su color negro ocupó lugar en el arte, en especial el grafito y todas las escrituras hechas con sus trazos.
El carbono y sus sólidos no representan ningún riesgo para la salud. ¿Quién se ha preocupado por una bolsa de carbón? Las venden a montones dentro de los pasillos de algunos mercados, y con tal no haya un incendio cercano, sus bloques negros no arderán.
El coque, por otro lado, sí puede representar un riesgo si su contenido de azufre es alto. Al combustionar liberará gases sulfurados que, además de ser tóxicos, contribuyen a la lluvia ácida. Y aunque el CO2 en pequeñas cantidades no puede asfixiarnos, sí ejerce un enorme impacto en el medio ambiente como gas invernadero.
Desde esta perspectiva, el carbono es un peligro “a largo plazo”, ya que su combustión altera el clima de nuestro planeta.
Y en un sentido más físico, los sólidos o materiales carbonáceos si se encuentran pulverizados son fácilmente transportados por las corrientes de aire; y en consecuencia, se introducen directo a los pulmones, lo cual puede dañarlos irremediablemente.
De resto, es muy común consumir “carbón” cuando se pasa de cocción algún alimento.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Andrew. (2019). Carbon, its Allotropes and Structures. Recuperado de: everyscience.com
- Advameg, Inc. (2019). Carbon. Chemistry Explained. Recuperado de: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11 de julio de 2018). 10 Carbon Facts (Atomic Number 6 or C). Recuperado de: thoughtco.com
- Tawnya Eash. (2019). What is Carbon? – Facts & History Lesson for Kids. Study. Recuperado de: study.com
- Föll. (s.f.). History of Carbon. Recuperado de: tf.uni-kiel.de
