Difenilamina: estructura química, propiedades, usos, preparación

¿Qué es la difenilamina?
La difenilamina es un compuesto orgánico cuya fórmula química es (C6H5)2NH. Su mismo nombre indica que se trata de una amina, así como también lo deja en claro su fórmula (–NH2). Por otro lado, el término “difenil” alude a la presencia de dos anillos aromáticos enlazados al nitrógeno. En consecuencia, la difenilamina es una amina aromática.
Dentro del mundo de los compuestos orgánicos, la palabra aromático no está necesariamente relacionada con la existencia de sus olores, sino con unas características que definen sus comportamientos químicos frente a determinadas especies.
Para el caso de la difenilamina, coinciden su aromaticidad y el hecho de que su sólido presente un aroma distintivo. Sin embargo, el fundamento o los mecanismos que rigen sus reacciones químicas pueden explicarse por su carácter aromático, más no por su agradable aroma.
Su estructura química, basicidad, aromaticidad e interacciones intermoleculares son las variables responsables de sus propiedades: desde el color de sus cristales hasta su aplicabilidad como agente antioxidante.
Estructura química de la difenilamina
En las imágenes superiores están representadas las estructuras químicas de la difenilamina. Las esferas negras corresponden a los átomos de carbono, las blancas a los átomos de hidrógeno y la azul al átomo de nitrógeno.
La diferencia entre ambas imágenes es el modelo de cómo representan gráficamente a la molécula. En la inferior resalta la aromaticidad de los anillos con las líneas punteadas en negro y, asimismo, la geometría plana de estos anillos queda en evidencia.
Ninguna de las dos imágenes muestra el par solitario de electrones no compartidos sobre el átomo de nitrógeno. Estos electrones se “pasean” por el sistema π conjugado de los dobles enlaces en los anillos. Este sistema conforma una especie de nube circulante que permite interacciones intermoleculares; es decir, con otros anillos de otra molécula.
Lo anterior significa que el par no compartido del nitrógeno se pasea por ambos anillos, distribuyendo en estos su densidad electrónica equitativamente, y luego regresan al nitrógeno, para repetir el ciclo otra vez.
En este proceso la disponibilidad de estos electrones disminuye, trayendo como consecuencia un descenso de la basicidad de la difenilamina (su tendencia a donar electrones como base de Lewis).
Usos/apliciones de la difenilamina
La difenilamina es un agente oxidante capaz de cumplir una serie de funciones, y entre ellas están las siguientes:
- Durante su almacenaje, las manzanas y las peras experimentan un proceso fisiológico llamado escaldadura, relacionado con la producción de trienos conjugados, que lleva a un daño de la piel de las frutas. La acción de la difenilamina permite aumentar el periodo de almacenaje, reduciendo el daño de las frutas a un 10 % de lo observado en su ausencia.
- Al combatir la oxidación, la difenilamina y sus derivados alargan el funcionamiento de los motores al evitar el espesamiento del aceite usado.
- La difenilamina es utilizada para limitar la acción del ozono en la manufactura del caucho.
- La difenilamina es usada en la química analítica para la detección de nitratos (NO3–), cloratos (ClO3–) y otros agentes oxidantes.
- Es un indicador usado en las pruebas de detección del envenenamiento con nitratos.
- Cuando el RNA es hidrolizado por una hora, reacciona con la difenilamina; esto permite su cuantificación.
- En la medicina veterinaria se utiliza la difenilamina en forma tópica en la prevención y el tratamiento de las manifestaciones del gusano barrenador en los animales de cría.
- Algunos de los derivados de la difenilamina pertenecen a la categoría de las drogas anti-inflamatorias no esteroideas. Asimismo, pueden tener efectos farmacológicos y terapéuticos como antimicrobianos, analgésicos, anticonvulsionantes y en la actividad anticancerígena.
Preparación de la difenilamina
De forma natural la difenilamina se produce en la cebolla, en los cilantros, en las hojas de té verde y negro, y en las cáscaras de los frutos cítricos. Sintéticamente, existen muchas rutas que llevan a este compuesto, como por ejemplo:
Desaminación térmica de la anilina
Se prepara por desaminación térmica de la anilina (C6H5NH2) en presencia de catalizadores oxidantes.
Si la anilina en esta reacción no incorpora un átomo de oxígeno a su estructura, ¿por qué se oxida? Porque el anillo aromático es un grupo atractor de electrones, a diferencia del átomo de H, que dona su baja densidad electrónica al nitrógeno en la molécula.
2C6H5NH2 => (C5H5)2 NH + NH3
Asimismo, la anilina puede reaccionar con la sal clorhidrato de anilina (C6H5NH3+Cl–) bajo un calentamiento de 230 ºC durante veinte horas.
C6H5NH2 + C6H5NH3+Cl– => (C5H5)2 NH
Reacción con fenotiazina
La difenilamina origina varios derivados al combinarse con diferentes reactivos. Uno de estos es la fenotiazina, que al sintetizarse con azufre es un precursor de derivados con acción farmacéutica.
(C6H5)2NH + 2S => S(C6H4) NH + H2S
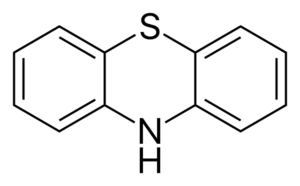
Propiedades de la difenilamina
La difenilamina es un sólido cristalino blanco que, dependiendo de sus impurezas, puede adquirir tonalidades broncíneas, ámbar o amarillas. Presenta un aroma agradable a flores, tiene un peso molecular 169,23 g/mol y una densidad de 1,2 g/mL.
Las moléculas de estos sólidos interaccionan por fuerzas de Van der Waals, entre las cuales están los puentes de hidrógeno formados por los átomos de nitrógeno (NH—NH) y el apilamiento de los anillos aromáticos, reposando sus “nubes electrónicas” una sobre la otra.
Como los anillos aromáticos ocupan mucho espacio, estos entorpecen los puentes de hidrógeno, sin considerar además las rotaciones de los enlaces N–anillo. Lo anterior ocasiona que el sólido no tenga un punto de fusión muy alto (53 ºC).
Sin embargo, en estado líquido las moléculas están más separadas y la eficacia de los puentes de hidrógeno mejora. Asimismo, la difenilamina es relativamente pesada, necesitando de mucho calor para pasar a fase gaseosa (302 ºC, su punto de ebullición). Esto también es debido en parte al peso y las interacciones de los anillos aromáticos.
Solubilidad y basicidad
Es muy insoluble en agua (0,03 g/100 g de agua) debido al carácter hidrófobo de sus anillos aromáticos. En cambio, es muy soluble en solventes orgánicos como benceno, tetracloruro de carbono (CCl4), acetona, etanol, piridina, ácido acético, etc.
Su constante de acidez (pKa) es 0,79, que alude a la acidez de su ácido conjugado (C6H5NH3+). El protón sumado al nitrógeno tiene tendencia a desprenderse, debido a que el par de electrones con el que está enlazado puede pasearse por los anillos aromáticos. Así, la alta inestabilidad C6H5NH3+ refleja la baja basicidad de la difenilamina.
Referencias
- The Lubrizol Corporation. (2018). Diphenylamine Antioxidants. Recuperado de lubrizol.com
- Arun Kumar Mishra, Arvind Kumar. (2017). Pharmacological Applications of Diphenylamine and Its Derivative as Potent Bioactive Compound: A Review. Current Bioactive Compounds, volume 13.
- PrepChem. (2015-2016). Preparation of diphenylamine. Recuperado de prepchem.com
- PubChem. (2018). Diphenylamine. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Wikipedia. (2018). Diphenylamine. Recuperado de en.wikipedia.org
