Estados de agregación de la materia: qué son, tipos, ejemplos
¿Qué son los estados de agregación de la materia?
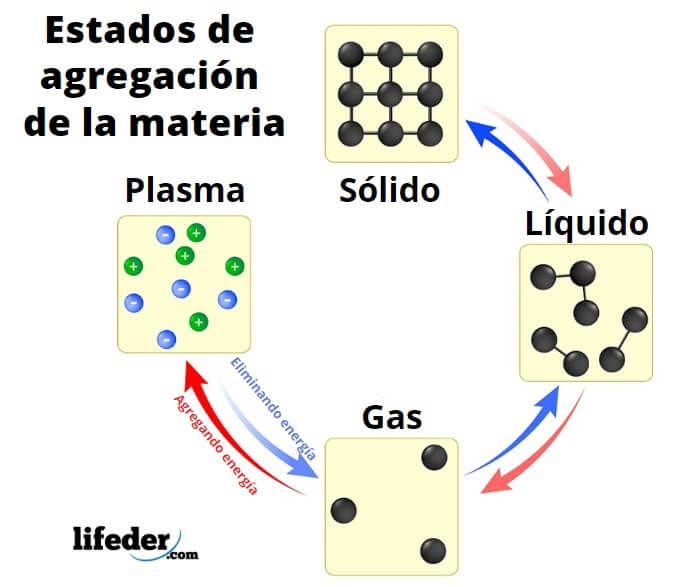
Los estados de agregación de la materiason las formas en las que la materia se manifiesta ante nuestros ojos y sentidos. Se relacionan directamente con el grado de interacciones de sus partículas conformantes, ya sea átomos, iones, moléculas, macromoléculas, células, etc.
Cuando se habla del grado de interacción, se refiere a qué tan fuertes las partículas se unen unas con otras para formar conjuntos, los cuales a su vez terminan definiendo una fase o estado material. Así, tenemos los tres estados fundamentales de agregación de la materia: sólido, líquido y gas, todos presentes aquí en la Tierra a grandes escalas.
Los océanos y mares son ejemplos de líquidos. La atmósfera y el aire que respiramos, corresponden al estado gaseoso. Mientras, los icebergs y la corteza terrestre representan los sólidos del planeta Tierra. Además de estos tres estados, se puede mencionar el coloidal, visto en las nubes del cielo y en sinfines de objetos naturales.
Existen asimismo otros estados de agregación de la materia que se consideran exóticos por desarrollarse solamente en los laboratorios o en territorios cósmicos bajo condiciones inimaginables de temperaturas y presiones. Algunos de ellos son el plasma, la materia neutrónica, la materia fotónica o los condensados de Bose-Einstein.
Estado de agregación líquido

En el líquido las interacciones entre las partículas son fuertes, pero no lo suficiente como para privarles de un libre movimiento. Por lo tanto, los conjuntos de partículas definen una sustancia que es capaz de ocupar todo el volumen de un recipiente, pero que al mismo tiempo experimenta la fuerza de atracción de la gravedad.
En consecuencia, el líquido presenta una superficie, la cual abarca todo el ancho del recipiente. Esto se observa en cualquier botella, tina, tanque, pozo, crisol, etc. Cuando se agita el recipiente, el líquido tiende a derramarse por sus bordes o a salpicar directamente hacia el suelo.
Una característica especial de los líquidos es que pueden fluir siguiendo las dimensiones de un canal o tubería.
Algunos ejemplos de líquidos son los siguientes:
-Agua
-Aceite
-Petróleo
-Lava
-Miel
-Jarabes
-Bromo
-Tetracloruro de carbono
-Tetracloruro de titanio
-Sales fundidas
-Metales fundidos
-Nitrógeno líquido
-Gasolina
-Cervezas
-Vinos
-Ácido acético glacial
Hay líquidos que fluyen más que otros, lo que quiere decir que presentan viscosidades distintas. Esta es una propiedad de los líquidos que sirve para caracterizarlos; es decir, para diferenciarlos entre sí.
Estado de agregación gaseoso
Los gases se visualizan como burbujas en los líquidos o como neblinas o vapores. Las interacciones entre sus partículas son débiles, lo que provoca que haya mucha distancia entre ellas. En consecuencia, conforman una sustancia que apenas siente los efectos de la gravedad, y que se difumina por todo el volumen del recipiente que la contiene.
En los gases las partículas, ya sean átomos, iones o moléculas, tienen la máxima libertad de movimiento. Dependiendo de sus masas, algunos gases pueden ser más densos que otros, lo que afecta directamente en su velocidad de propagación por el espacio.
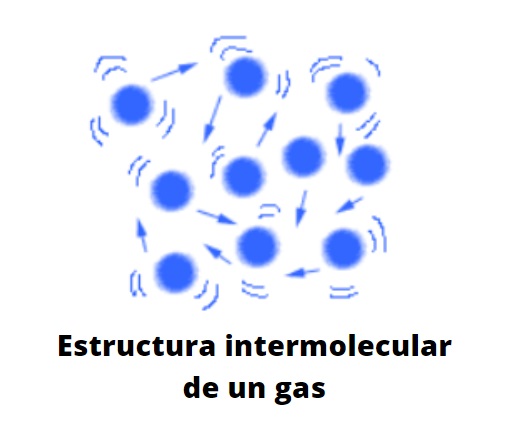
Este estado de agregación de la materia se considera escurridizo, fugaz, inasible (intocable) y disperso.
Algunos ejemplos de gases son:
-Vapor de agua
-Dióxido de carbono
-Aire
-Flatulencias
-Amoníaco
-Oxígeno
-Hidrógeno
-Helio
-Cloro
-Flúor
-Metano
-Gas natural
-Etano
-Acetileno
-Fosfina
-Fosgeno
-Silano
-Óxidos de nitrógeno (NOx)
-Dióxido y trióxido de azufre
-Ozono
-Hexafluoruro de azufre
-Dimetiléter
Los gases en general son indeseables, pues en caso de fugas se expanden rápidamente por todo el espacio, y suelen representar además severos riesgos de incendio o envenenamiento. Asimismo, los gases desarrollan peligrosas presiones durante muchos procesos industriales, y son los contaminantes o desechos que más impactan a la atmósfera.
Estado de agregación sólido

El estado de agregación sólido se caracteriza porque sus partículas presentan fuertes interacciones. En consecuencia, experimentan toda la fuerza gravitatoria del planeta, por lo que definen sus propios volúmenes sin importar en qué recipientes estén, dejando varios espacios huecos o vacíos.

Los sólidos se caracterizan por existir como cuerpos cristalinos o amorfos, según el grado de ordenamiento de sus partículas. Asimismo, cuentan con otras propiedades como la dureza, la impenetrabilidad y la densidad.
Algunos ejemplos de sólidos son:
-Hielo
-Huesos
-Hielo seco
-Carbón
-Grafito
-Diamante
-Minerales
-Sales
-Rocas
-Madera
-Carne
-Fibras vegetales
-Plásticos
-Fibras textiles
-Metales
-Grasas sólidas
-Aleaciones
-Vidrios
-Yodo
-Complejos metálicos
Los sólidos en general son las sustancias más deseables, pues son las más fáciles de almacenar y manipular. Asimismo, corresponden a los cuerpos con los que más podemos interactuar con nuestros sentidos. Es por esta razón que el desarrollo de nuevos materiales casi siempre despierta más interés que el descubrimiento de nuevos líquidos o gases.
Estado de agregación coloidal

Aunque no se considere uno de los estados fundamentales de la materia, junto al sólido, líquido o gas, lo cierto es que el estado coloidal es bastante común en la naturaleza y en la industria, abarcando un inmenso número de mezclas. Precisamente, el estado coloidal no se da en sustancias puras, sino en mezclas, donde uno de los componentes se dispersa en una fase mayor.
Al ser una mezcla, las dos fases presentan sus propios estados de agregación. Por ejemplo, la fase dispersa puede ser sólida, mientras la fase mayoritaria o dispersante puede ser también sólida, gaseosa o líquida. Son varias las posibilidades y combinaciones. Por lo tanto, son muchos los cuerpos coloidales que se hallan en la naturaleza.
Algunos ejemplos de sustancias coloidales son:
-Nubes
-Humo
-Neblina y niebla
-Sangre
-Helados
-Leche
-Mayonesa
-Salsa de tomate
-Mantequilla
-Gelatina
-Crema de maní
-Papeles
-Vidrios pintados
-Pinturas
-Cosméticos
-Quesos
-Porcelana
-Espuma
-Malvaviscos
Ahora bien, las suspensiones como tal quedan fuera de los estados de agregación de la materia, ya que las interacciones entre sus componentes no son tan “íntimas” como sucede con los coloides.
Son simplemente mezclas cuyas propiedades no difieren demasiado de lo que se conoce por líquidos o sólidos. Por ejemplo, el lodo, una suspensión, se considera simplemente como “agua con mucha tierra”.
Estado de agregación plasmático
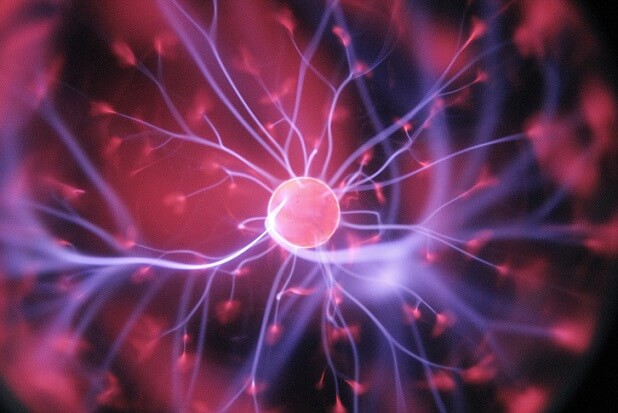
En el estado de agregación del plasma se da un paso a la materia exótica. Ya no se habla propiamente de átomos, moléculas o iones, sino de protones, neutrones y electrones. Se origina cuando un gas recibe altas descargas eléctricas, o experimenta un inmenso calor. Cuando sucede esto, se ioniza, es decir, pierde electrones para ganar cargas positivas.
A medida que pierde electrones, se van formando iones gaseosos, hasta que finalmente sus núcleos atómicos quedan desnudos. Se tendrá entonces una “sopa dorada” de protones, neutrones y electrones. En dicha sopa las partículas tienen un comportamiento colectivo, lo que significa que sus movimientos influyen directamente sobre los de sus vecinos. No muestran un comportamiento tan libre como el de los gases.
Los plasmas se caracterizan por ser sustancias brillantes y calientes, las cuales integran el “tejido” estelar. Por lo tanto, se hallan en las estrellas y en nuestro Sol, siendo posiblemente el estado de la materia más abundante del Universo. Sin embargo, también pueden originarse aquí en la Tierra.
Algunos ejemplos de plasmas son:
-Fuego
-Rayos eléctricos
-Luces de neón
-Láseres
-Lámparas fluorescentes
-Vientos solares
-Nebulosas
-Televisores de plasma
-Cola de los cometas
El grado de ionización del plasma y, por ende, su energía, puede variar, habiendo plasmas utilizables en aplicaciones e instrumentos de la vida diaria.
Condensado de Bose Einstein
Predicho por los científicos Albert Einstein y Satyendra Nath Bose, el condensado de Bose-Einstein es un estado en el que los bosones, en este caso átomos de rubidio o de sodio, se aglomeran en el menor estado energético a muy bajas temperaturas, rozando el cero absoluto.
A estas temperaturas, los átomos se aglomeran o condensan de tal modo, que se comportan como si fueran una única entidad: un superátomo.
Estado de agregación neutrónico
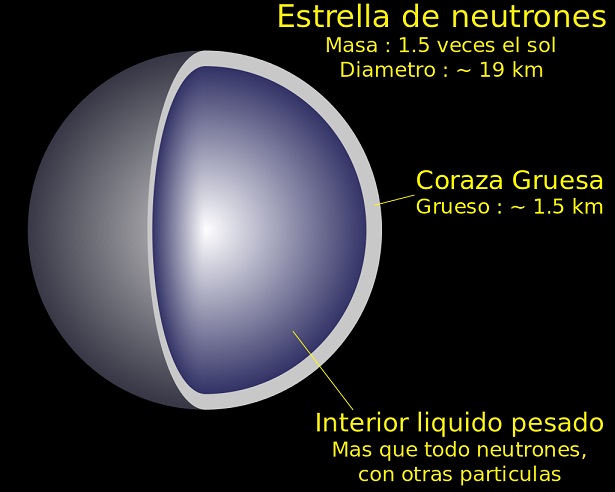
La materia neutrónica se halla unos cuantos pasos por delante del plasma. Ahora, las condiciones que experimentan las partículas son tan intensas, que los protones y los electrones se fusionan para dar lugar a neutrones. Se tendrá por lo tanto, una cantidad inimaginable de neutrones altamente compactados.
El estado de agregación neutrónico se encuentra en las famosas estrellas de neutrones, siendo parte de los cuerpos celestiales más interesantes e investigados por la astronomía. Algunos acuñan con el término ‘neutronio’ a la materia compuesta exclusivamente por neutrones, y ha sido fuente de inspiración para muchas obras de ciencia ficción.
Estado de agregación fotónico
Hasta el momento se ha hablado de las interacciones que existen entre átomos, protones, neutrones, electrones, moléculas, etc., para conformar distintos estados de agregación de la materia. Yendo todavía más allá, colindando con la fantasía, son posibles las interacciones entre los fotones de la luz. Sin embargo, no cualquier luz, sino una de muy baja energía.
Para lograr que interaccionen fotones de muy baja energía, y que formen así “moléculas fotónicas” de dos o tres fotones, es necesario hacer que atraviesen una nube de átomos congelados de rubidio. A estas temperaturas y condiciones, los fotones ingresan a la nube como entidades individuales, y salen de ellas en pares o tríos.
Se especula que tales interacciones podrán algún día aprovecharse para almacenar información en los ordenadores cuánticos, volviéndolos mucho más poderosos y rápidos.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2020). State of matter. Recuperado de: en.wikipedia.org
- Chem.Purdue. (s.f.). States of Matter. Recuperado de: chem.purdue.edu
- Rader Andrew. (2018). States of Matter. Recuperado de: chem4kids.com
- María Estela Raffino. (12 de febrero de 2020). Estados de agregación de la materia. Concepto.de. Recuperado de: concepto.de
- Chu Jennifer. (15 de febrero de 2018). Physicists create new form of light. MIT News. Recuperado de: news.mit.edu
