Dióxido de azufre (SO2): estructura, propiedades, usos, riesgos
El dióxido de azufre es un compuesto inorgánico gaseoso formado por azufre (S) y oxígeno (O), siendo su fórmula química SO2. Es un gas incoloro con olor irritante y sofocante. Además, es soluble en agua formando soluciones ácidas. Los volcanes lo expulsan hacia la atmósfera durante las erupciones.
Forma parte del ciclo biológico y geoquímico del azufre, pero es producido en grandes cantidades por ciertas actividades humanas como la refinación del petróleo y la quema de combustibles fósiles (carbón o diésel por ejemplo).

El SO2 es un agente reductor que permite que la pulpa de papel permanezca blanca luego del blanqueo con otros compuestos. También sirve para eliminar restos de cloro en el agua que ha sido tratada con este químico.
Es utilizado para conservar algunos tipos de alimentos, para desinfectar recipientes donde se produce la fermentación del jugo de uvas para producir vino o de la cebada para hacer cerveza.
También se emplea como fungicida en agricultura, para obtener ácido sulfúrico, como solvente y como intermediario en reacciones químicas.
El SO2 presente en la atmósfera es dañino para muchas plantas, en el agua afecta los peces y además es uno de los responsables de la “lluvia ácida” la cual corroe los materiales creados por el ser humano.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Presencia en la naturaleza
- 6 Usos
- 7 Efectos del SO2 endógeno
- 8 Riesgos
- 9 Referencias
La molécula del dióxido de azufre es simétrica y forma un ángulo. El ángulo se debe a que el SO2 posee un par de electrones solitarios, esto es, electrones que no forman enlace con ningún átomo sino que están libres.
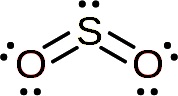
– Dióxido de azufre
– Anhídrido sulfuroso
– Óxido sulfuroso.
Gas incoloro.
64,07 g/mol
-75,5 ºC
-10,05 ºC
Gas: 2,26 a 0 °C (relativa al aire, esto es, densidad del aire = 1). Esto significa que es más pesado que el aire.
Líquido: 1,4 a -10 °C (relativa al agua, es decir, densidad del agua = 1).
Soluble en agua: 17,7% a 0 °C; 11,9% a 15 °C; 8,5% a 25 °C; 6,4% a 35 °C.
Soluble en etanol, éter dietílico, acetona y cloroformo. Es menos soluble en solventes no polares.
Las soluciones acuosas de SO2 son ácidas.
El SO2 es un poderoso agente reductor y oxidante. En presencia de aire y de un catalizador se oxida a SO3.
SO2 + O2 → SO3
Los pares de electrones solitarios hacen que en ocasiones se comporte como base de Lewis, en otras palabras, puede reaccionar con compuestos en donde haya algún átomo que le falten electrones.
Si el SO2 está en forma de gas y seco no ataca el hierro, acero, aleaciones de cobre-níquel, o de níquel-cromo-hierro. Sin embargo, si se encuentra en estado líquido o húmedo produce corrosión a dichos metales.
El SO2 líquido con un 0,2% de agua o más produce fuerte corrosión al hierro, latón y cobre. Es corrosivo para el aluminio.
Cuando está líquido también puede atacar algunos plásticos, gomas y recubrimientos.
El SO2 es muy soluble en agua. Se consideró durante mucho tiempo que en agua forma ácido sulfuroso H2SO3, pero no se ha demostrado la existencia de este ácido.
En las soluciones de SO2 en agua ocurren los siguientes equilibrios:
SO2 + H2O ⇔ SO2.H2O
SO2.H2O ⇔ HSO3– + H3O+
HSO3– + H2O ⇔ SO32- + H3O+
Donde HSO3– es el ion bisulfito y el SO32- es el ion sulfito. El ion sulfito SO32- se produce principalmente cuando se añade un álcali a la solución de SO2.
Las soluciones acuosas de SO2 poseen propiedades reductoras, especialmente si son alcalinas.
– Es extremadamente estable frente al calor, incluso hasta 2000 °C.
– No es inflamable.
El SO2 se obtiene por combustión del azufre (S) en el aire, aunque se forman también pequeñas cantidades de SO3.
S + O2 → SO2
También se puede producir por calentamiento en el aire de diversos sulfuros, quemando minerales de pirita y minerales que contienen sulfuros, entre otros.
En el caso de la pirita de hierro, al oxidarse se obtiene el óxido de hierro (iii) y el SO2:
4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2↑
El SO2 es liberado a la atmósfera por la actividad de los volcanes (9%) pero también se origina por otras actividades naturales (15%) y por las acciones humanas (76%).
Las erupciones volcánicas explosivas causan fluctuaciones o variaciones anuales significativas del SO2 en la atmósfera. Se estima que el 25% del SO2 emitido por los volcanes es lavado por la lluvia antes de alcanzar la estratosfera.
Las fuentes naturales son las más abundantes y se deben al ciclo biológico del azufre.
En zonas urbanas e industriales las fuentes humanas predominan. La principal actividad humana que lo produce es la quema de combustibles fósiles, como el carbón, la gasolina y el diésel. Otras fuentes humanas son las refinerías de petróleo, plantas químicas y producción de gas.

En los mamíferos se genera de forma endógena, es decir, dentro del organismo de animales y humanos debido al metabolismo de los aminoácidos que contienen azufre (S), especialmente la L-cisteína.
Una de las aplicaciones más importantes del SO2 es en la obtención de ácido sulfúrico H2SO4.
2 SO2 + 2 H2O + O2 → 2 H2SO4
El dióxido de azufre se emplea como conservante y estabilizador de alimentos, como agente para el control de la humedad y como modificador del sabor y de la textura de ciertos productos comestibles.
También se utiliza para desinfectar equipos que entran en contacto con comestibles, equipos de fermentación, como los de cervecerías y vinerías, contenedores de comidas, etc.
Permite conservar frutas y vegetales, incrementa su vida en el estante del supermercado, previene la pérdida de color y sabor y ayuda en la retención de vitamina C (ácido ascórbico) y carotenos (precursores de la vitamina A).

Sirve para conservar vino, pues destruye bacterias, hongos y levaduras no deseadas. También se utiliza para esterilizar y prevenir la formación de nitrosaminas en la cerveza.

Además se usa para remojar granos de maíz, para blanquear azúcar de remolacha y como antimicrobiano en la manufactura de jarabe de maíz alto en fructosa.
Ha sido muy utilizado como solvente no acuoso. Aunque no es un solvente ionizante, es útil como solvente libre de protones para ciertas aplicaciones analíticas y reacciones químicas.
Se emplea como solvente y reactivo en síntesis orgánica, intermediario en la producción de otros compuestos como dióxido de cloro, cloruro de acetilo y en la sulfonación de aceites.
Se emplea como agente reductor a pesar de no ser tan fuerte, y en solución alcalina se forma el ion sulfito que es un agente reductor más enérgico.
El SO2 se utiliza también:
– En agricultura como fungicida y conservante de uvas después de la cosecha.
– Para fabricar hidrosulfitos.
– Para blanquear pulpa de madera y papel, pues permite estabilizar la pulpa luego del blanqueo con peróxido de hidrógeno H2O2; el SO2 actúa destruyendo el H2O2 remanente y así mantener el brillo de la pulpa, pues el H2O2 puede causar una reversión del brillo.
– Para blanquear fibras textiles y artículos de mimbre.
– Para tratar aguas pues elimina el cloro residual que queda luego de la cloración de agua potable, aguas residuales o aguas industriales.
– En la refinación de minerales y metales, como agente reductor del hierro durante el procesamiento del mineral.
– En la refinación del petróleo para atrapar oxígeno y retardar la corrosión, y como solvente de extracción.
– Como antioxidante.
– Como neutralizador de álcalis en la manufactura del vidrio.
– En baterías de litio como agente oxidante.
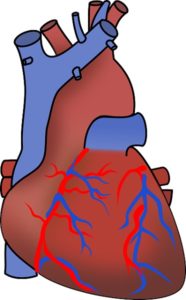
Ciertos estudios han revelado que el SO2 endógeno o producido por el propio organismo posee un efecto beneficioso en el sistema cardiovascular, incluyendo la regulación de la función del corazón y la relajación de los vasos sanguíneos.
Cuando se produce en el organismo el SO2 se convierte en sus derivados bisulfito HSO3– y sulfito SO32-, los cuales ejercen un efecto vasorelajador de las arterias.
El SO2 endógeno disminuye la hipertensión, previene el desarrollo de la aterosclerosis y protege el corazón de daños al miocardio. También ejerce una acción antioxidante, inhibe la inflamación y la apoptosis (muerte celular programada).
Por estas razones se piensa que puede ser una posible nueva terapia para las enfermedades cardiovasculares.
– La exposición al SO2 gaseoso puede derivar en quemaduras en ojos, piel, garganta y membranas mucosas, daño en bronquios y pulmones.
– Algunos estudios reportan que posee un riesgo potencial de daño al material genético de las células de los mamíferos y humanos.
– Es corrosivo. No es inflamable.
El dióxido de azufre es el gas contaminante más común de la atmósfera, especialmente en zonas urbanas e industriales.
Su presencia en la atmósfera contribuye a la denominada “lluvia ácida” que es dañina para los organismos acuáticos, peces, vegetación terrestre y corrosión a materiales hechos por el ser humano.

El SO2 es tóxico para los peces. Las plantas verdes son extremadamente sensibles al SO2 atmosférico. La alfalfa, el algodón, la cebada y el trigo resultan dañados con niveles ambientales bajos, mientras que papas, cebollas y maíz son mucho más resistentes.
A pesar de que es inofensivo para personas sanas, cuando se usa en las concentraciones recomendadas por los organismos de salud autorizados, el SO2 puede inducir asma a personas sensibles que lo ingieren con los alimentos.
Los alimentos que suelen contenerlo son las frutas desecadas, refrescos artificiales y bebidas alcohólicas.
- U.S. National Library of Medicine. (2019). Sulfur dioxide. Recuperado de pubchem.ncbi.nlm.nih.gov.
- Huang, Y. et al. (2016). Endogenous Sulfur Dioxide: A New Member of Gasotransmitter Family in the Cardiovascular System. Oxid Med Cell Longev. 2016; 2016: 8961951. Recuperado de ncbi.nlm.nih.gov.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Windholz, M. et al. (editors) (1983). The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals. Tenth Edition. Merck & CO., Inc.
- Pan, X. (2011). Sulfur Oxides: Sources, Exposures and Health Effects. Health Effects of Sulfur Oxides. In Encyclopedia of Environmental Health. Recuperado de sciencedirect.com.
- Tricker, R. and Tricker, S. (1999). Pollutants and contaminants. Sulphur dioxide. In Environmental Requirements for Electromechanical and Electronic Equipment. Recuperado de sciencedirect.com.
- Bleam, W. (2017). Acid-Base Chemistry. Sulfur Oxides. In Soil and Environmental Chemistry (Second Edition). Recuperado de sciencedirect.com.
- Freedman, B.J. (1980). Sulphur dioxide in foods and beverages: its use as a preservative and its effect on asthma. Br J Dis Chest. 1980; 14(2):128-34. Recuperado de ncbi.nlm.nih.gov.
- Craig, K. (2018). A Review of the Chemistry, Pesticide Use, and Environmental Fate of Sulfur Dioxide, as Used in California. In Reviews of Environmental Contamination and Toxicology. Volume 246. Recuperado de link.springer.com.
