Aldosterona: funciones, síntesis, mecanismo de acción
La aldosterona, también conocida como electrocortina, es una hormona esteroidea (derivada del ciclopentano perhidrofenantreno) sintetizada por la porción glomerular de la corteza suprarrenal y que se relaciona con el control de los niveles de sodio, potasio y agua en el líquido extracelular.
Todas las hormonas esteroideas se sintetizan a partir de colesterol que puede derivar de tres fuentes: de la dieta (casi el 80%), a partir de acetato o a partir de las reservas de ésteres de colesterol que poseen los tejidos que producen estas hormonas (tejidos esteroidogénicos).
El colesterol que ingresa con la dieta es transportado en el plasma sanguíneo de los humanos por medio de las lipoproteínas de baja densidad o LDL (del inglés Low-density Lipoprotein) y es introducido a las células por mecanismos de endocitosis específicos.
La albúmina y las globulinas plasmáticas (proteínas de la sangre) actúan como transportadores para las hormonas esteroideas. El transporte de la aldosterona se da por un mecanismo inespecífico y aproximadamente el 50% de la aldosterona plasmática se encuentra en estado libre.
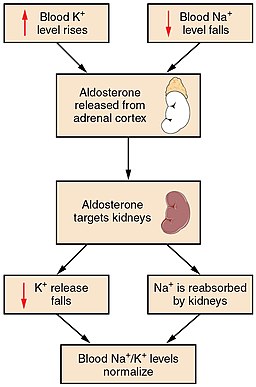
El aumento de la ACTH u hormona adrenocorticotrofina, de la angiotensina y del potasio plasmático, la disminución plasmática de sodio y del factor natriurético auricular, son algunos de los factores que estimulan la síntesis y liberación de aldosterona.
Esta hormona participa en la inducción de la reabsorción de sodio en el conducto colector renal, aumentando su entrada a través de los canales de sodio de este conducto. Así mismo se promueve la salida y excreción renal de potasio y de H+.
Los valores normales de aldosterona plasmática dependen de la ingesta de sodio; varían entre 80-250 pmol/L y pueden llegar hasta 300-900 mmol/L en pacientes con dietas altas en sodio.
Índice del artículo
La función principal de la aldosterona es regular los niveles de Na+ y agua del líquido extracelular, así como regular la secreción de K+ y H+ por los riñones y modificar la secreción de iones en otros tejidos como las glándulas salivales, la mucosa intestinal y las glándulas sudoríparas.
La aldosterona promueve la absorción renal de sodio y la excreción de potasio e hidrogeniones, como resultado se retiene sodio y aumenta la eliminación urinaria de potasio e hidrogeniones. El agua se reabsorbe junto con el sodio por un efecto osmótico.
Debido a que maneja los electrolitos, esta hormona también recibe el nombre de hormona mineralocorticoide suprarrenal. Es el mineralocorticoide natural más potente y es transportada en el plasma sanguíneo en forma libre o asociada con algunas proteínas.
La vida media de la aldosterona es de unos 15 a 20 minutos y el hígado se encarga de su eliminación rápida mediante la formación de un metabolito a partir de la aldosterona que recibe el nombre de tetrahidroxi aldosterona 3-glucurónido, que luego es eliminado por el riñón a través de la orina.
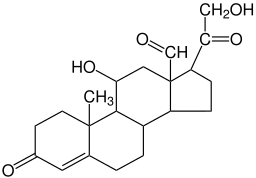
El nombre químico de la aldosterona es el 11β,21-Dihidroxi-3,20-dioxo-4-pregne-18-al. Su síntesis se lleva a cabo en las células de la zona glomerulosa o subcapsular de la corteza de las glándulas suprarrenales (unas glándulas muy importantes ubicadas en la región superior de los riñones).
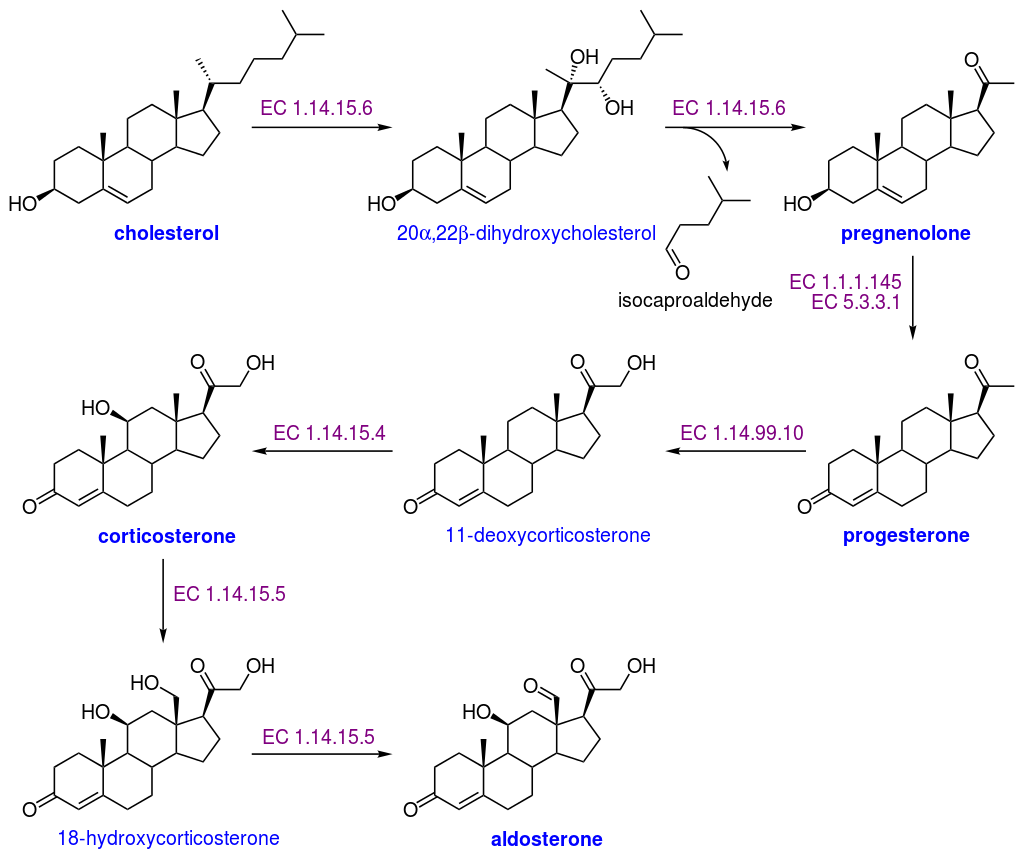
La síntesis de la aldosterona se inicia con el transporte de colesterol desde el citosol celular hacia el interior de la mitocondria.
El primer paso es la conversión del colesterol en pregnenolona, que luego se convierte en progesterona y después en desoxicorticosterona (DOC), en corticosterona y finalmente en aldosterona.
El transporte del colesterol hacia el interior del citosol acuoso, donde es poco soluble, se da por medio de una proteína portadora de esteroles conocida como “proteína portadora de esteroles 2” o SPD-2. Esta es la proteína encargada del transporte del colesterol hasta la mitocondria.
Otra proteína llamada StAR (Regulador Esteroidogénico Inmediato) permite la entrada del colesterol hacia el espacio intermembrana (a través de la membrana externa de la mitocondria).
En el interior de las mitocondrias, la mayor parte de las enzimas esteroidogénicas forman parte del complejo de oxidasas del citocromo P450.
La conversión del colesterol en pregnenolona se da por la enzima de escisión de la cadena lateral del colesterol, mejor conocida como P450scc. Las enzimas de este tipo cortan la cadena lateral del colesterol en la mitocondria, así como también las hidroxilaciones en las posiciones 20α y 22 y escinde el enlace entre los carbonos 20-22.
Las enzimas 3β-HSD (3 β-hidroxiesteroide deshidrogenasa) y la Δ5,4isomerasa, que no forman parte del complejo P450, median la transformación de la pregnenolona en progesterona por hidroxilación e isomerización, respectivamente.
Esta reacción ocurre en el retículo endoplásmico de las células productoras de aldosterona en la corteza suprarrenal.
La enzima P450c21 es una 21-hidroxilasa que transforma a la progesterona en 11-desoxicorticosterona, que es posteriormente hidroxilada por la 11β-hidroxilasa y se convierte en corticosterona.
La enzima 18-hidroxilasa o aldosterona sintetasa transforma, por hidroxilación, a la corticosterona en 18-hidroxicorticosterona que, al cambiar el alcohol en posición 18 por un grupo aldehído, rinde aldosterona.
Tanto la secreción como la función de la aldosterona dependen de varios elementos, entre los que se encuentran el factor natriurético o FNA y la angiotensina II. El FNA es una hormona peptídica sintetizada por el músculo auricular y secretada por estas células como respuesta al estiramiento auricular.
Otros factores, aunque menos potentes, también se relacionan con la secreción de aldosterona y estos son: la hormona adrenocorticotrofina (ACTH), el sodio y el potasio plasmáticos.
La ACTH o la adrenocorticotrofina es una hormona producida por la hipófisis. Su secreción es estimulada por la CRH u hormona liberadora de corticotropina, que es una hormona sintetizada y liberada por el hipotálamo y que forma parte del eje hipotálamo-hipófisis-corteza suprarrenal para la regulación de la secreción de aldosterona.
El mecanismo de regulación de este eje hipotálamo-hipófisis-corteza suprarrenal es un mecanismo de retroalimentación negativa, donde los productos finales de la estimulación terminan inhibiendo la secreción de las diferentes hormonas de este eje.
El aumento de la angiotensina II se debe a la estimulación de la secreción de renina por las células granulares del aparato yuxtaglomerular renal. Estas células secretan renina estimuladas por varios factores como son:
– La disminución de la presión de perfusión renal
– Los cambios en la composición del líquido tubular que baña la mácula densa en el riñón o
– La estimulación de los nervios simpáticos renales y otros factores
La renina es una enzima proteolítica que rompe al angiotensinógeno y lo convierte en angiotensina I, que es convertida en angiotensina II por la enzima convertidora de angiotensina II. La angiotensina II, como se comentó, estimula la liberación de aldosterona.
Si aumenta la ingesta de sodio incrementa el volumen plasmático y esto, a su vez, por vía refleja, disminuye el tono simpático renal, lo que disminuye también la producción de renina y de angiotensina. El aumento del volumen plasmático provoca un aumento en la secreción del FNA.
Tanto la disminución de la angiotensina II como el aumento del FNA producen una disminución de la secreción de aldosterona, lo que a su vez aumenta la excreción renal de sodio y agua y así se regula la concentración de este ion frente a cambios en su consumo.
El principal órgano blanco de la aldosterona es el riñón, específicamente el túbulo colector y el túbulo distal.
En esta zona, la aldosterona ingresa a las células y se une a un receptor intracelular. El complejo de unión de la aldosterona y el receptor difunden hacia el núcleo y se inician las funciones de hormonales.
La capacidad de la aldosterona para aumentar la reabsorción de sodio se debe a varios mecanismos. Esta hormona aumenta el número de canales de sodio en el borde luminal de las células del túbulo colector.
Esto se produce, por un lado, porque estimula la presentación de estos canales en la superficie de las células del túbulo contorneado distal y del túbulo colector y, por otro lado, porque aumenta síntesis de los mismos.
La aldosterona estimula indirectamente a la bomba sodio/potasio de la superficie basolateral de las células del túbulo colector. Esta bomba saca sodio hacia el líquido intersticial, lo que facilita la entrada de sodio a la célula tubular al mantener elevado el gradiente electroquímico para este ion.
Así mismo, la cantidad de sodio que se reabsorbe es dependiente de la carga. Cuanto más sodio traiga el líquido que entra al tubo colector más sodio se absorberá, debido a que mayor será el potencial electroquímico transepitelial que empuja al sodio. Esto se incrementa por la aldosterona.
Los valores normales de aldosterona en el plasma sanguíneo dependen de la ingesta de sodio y de la posición corporal en la que se mida.
En posición recostada (decúbito dorsal) y reportados bajo el sistema internacional (SI), con una ingesta de sodio alta (entre 100 y hasta 200 mEq/día de sodio), los valores varían entre 80 y 250 pmol/L que, bajo unidades convencionales, serían de 3 a 9 ng/dL.
En posición recostada (decúbito dorsal) con ingesta de sodio baja (de 10 mEq/día de sodio), los valores normales están entre 300-900 mmol/L (SI) y 12-36 ng/dL en unidades convencionales.
En posición de pie y con ingesta alta de sodio, los valores varían entre 100 y 800 mmol/L (SI) y entre 4 y 30 ng/dL. En esta misma posición, pero con ingesta de sodio baja, los valores normales están entre 450 y 3800 mmol/L (SI) o entre 17 y 137 ng/dL en unidades convencionales.
Sin embargo, cada laboratorio reporta los valores normales de acuerdo con el método de medición que se utilice.
- Gardner, D. G., Shoback, D., & Greenspan, F. S. (2007). Greenspan’s basic & clinical endocrinology. McGraw-Hill Medical,
- Murray, R. K., Granner, D. K., Mayes, P., & Rodwell, V. (2009). Harper’s illustrated biochemistry. 28 (p. 588). New York: McGraw-Hill.
- Booth, R. E., Johnson, J. P., & Stockand, J. D. (2002). Aldosterone. Advances in physiology education, 26(1), 8-20.
- Connell, J. M., & Davies, E. (2005). The new biology of aldosterone. Journal of Endocrinology, 186(1), 1-20.
- Ganong, W. F., & Barrett, K. E. (2012). Ganong’s review of medical physiology. McGraw-Hill Medical.
