Hidruro de litio: estructura, propiedades, obtención, usos
El hidruro de litio es un sólido inorgánico cristalino cuya fórmula química es LiH. Es la sal inorgánica más liviana, su peso molecular es de solo 8 g/mol. Está formado por la unión de un ion litio Li+ y un ion hidruro H–. Ambos están unidos por un enlace iónico.
El LiH posee un alto punto de fusión. Reacciona fácilmente con el agua y en la reacción se produce gas hidrógeno. Se puede obtener mediante la reacción entre el metal litio fundido y el gas hidrógeno. Es ampliamente usado en reacciones químicas para la obtención de otros hidruros.
El LiH ha sido usado para protección contra radiaciones peligrosas como las que se hallan en los reactores nucleares, estos es, las partículas ALFA, BETA, radiaciones GAMMA, protones, rayos X y neutrones.
También se ha propuesto para la protección de los materiales de los cohetes espaciales movidos por propulsión térmica nuclear. Se están realizando estudios incluso para ser usado como protección del ser humano contra las radiaciones cósmicas durante los futuros viajes al planeta Marte.
Índice del artículo
- 1 Estructura
- 2 Nomenclatura
- 3 Propiedades
- 4 Obtención
- 5 Uso como escudo protector contra radiaciones peligrosas
- 6 Uso como medio de almacenamiento y transporte seguro de hidrógeno
- 7 Uso en reacciones químicas
- 8 Referencias
En el hidruro de litio el hidrógeno posee una carga negativa H–, pues le ha sustraído un electrón al metal, el cual está en forma de ion Li+.
La configuración electrónica del catión Li+ es: [He] 1s2 la cual es muy estable. Y la estructura electrónica del anión hidruro H– es: 1s2, que también es muy estable.
El catión y el anión se unen por fuerzas electrostáticas.
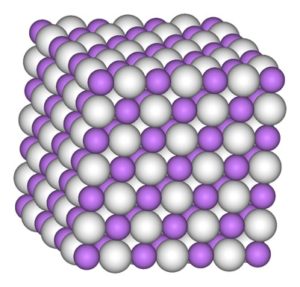
El cristal de hidruro de litio posee la misma estructura que el cloruro de sodio NaCl, es decir, una estructura cristalina cúbica.
– Hidruro de litio
– LiH
Sólido cristalino blanco o incoloro. El LiH comercial puede ser azul grisáceo debido a la presencia de pequeñas cantidades de metal litio.
8 g/mol
688 ºC
Se descompone a 850 ºC.
200 ºC
0,78 g/cm3
Reacciona con el agua. Es insoluble en éteres e hidrocarburos.
El hidruro de litio es mucho más estable que los hidruros de los otros metales alcalinos y puede ser fundido sin descomposición.
No es afectado por el oxígeno si se calienta a temperaturas por debajo del rojo. Tampoco es afectado por el cloro Cl2 y el ácido clorhídrico HCl.
El contacto del LiH con calor y humedad causa una reacción exotérmica (genera calor) y evolución de hidrógeno H2 e hidróxido de litio LiOH.
Puede formar un polvillo fino que puede explotar en contacto con llamas, calor o materiales oxidantes. No debe entrar en contacto con óxido nitroso ni oxígeno líquido, pues puede explotar o encenderse.
Se oscurece al estar expuesto a la luz.
El hidruro de litio se ha obtenido en laboratorio mediante la reacción entre el metal litio fundido y el gas hidrógeno a una temperatura de 973 K (700 ºC).
2 Li + H2 → 2 LiH
Se obtienen buenos resultados cuando se aumenta la superficie expuesta del litio fundido y cuando se disminuye el tiempo de sedimentación del LiH. Es una reacción exotérmica.
El LiH presenta una serie de características que lo hacen atractivo para ser utilizado como protección para el ser humano en reactores nucleares y sistemas espaciales. A continuación alguna de estas características:
– Posee un alto contenido de hidrógeno (12,68 % en peso de H) y un alto número de átomos de hidrógeno por unidad de volumen (5,85 x 1022 átomos de H/cm3).
– Su alto punto de fusión permite que sea utilizado en ambientes de alta temperatura sin que se funda.
– Posee una presión baja de disociación (~20 torr en su punto de fusión) lo que permite que el material sea fundido y congelado sin degradarse bajo una presión baja de hidrógeno.
– Tiene una densidad baja lo que lo hace atractivo para ser usado en sistemas espaciales.
– Sin embargo, sus desventajas son su baja conductividad térmica y propiedades mecánicas pobres. Pero esto no ha disminuido su aplicabilidad.
– Las piezas de LiH que sirven como escudos se fabrican mediante prensado en frío o en caliente y mediante fusión y vertido en moldes. Aunque esta última forma es preferida.
– A temperatura ambiente las piezas se protegen del agua y del vapor de agua y a altas temperaturas mediante una pequeña sobrepresión de hidrógeno en un recipiente sellado.
En los reactores nucleares hay dos tipos de radiaciones:
Radiaciones directamente ionizantes
Son partículas altamente energéticas que llevan carga eléctrica, como las partículas alfa (α) y beta (β) y los protones. Este tipo de radiaciones interactúan muy fuertemente con los materiales de los escudos, causando ionización al interactuar con los electrones de los átomos de los materiales a través de los cuales pasan.
Radiaciones indirectamente ionizantes
Son los neutrones, los rayos gamma (γ) y los rayos X, que son penetrantes y requieren una protección masiva, ya que involucran la emisión de partículas secundarias cargadas, que son las que causan ionización.

Según algunas fuentes, el LiH es efectivo para proteger materiales y personas contra estos tipos de radiaciones.
El LiH ha sido escogido recientemente como un potencial moderador y material protector contra radiaciones nucleares para los sistemas de propulsión térmica nuclear de las naves espaciales para viajes muy largos.

Su baja densidad y alto contenido de hidrógeno hace que se pueda reducir de forma efectiva la masa y el volumen del reactor de propulsión nuclear.
La exposición a la radiación espacial es el riesgo más importante para la salud humana en las futuras misiones de exploración interplanetarias.
En el espacio profundo los astronautas estarán expuestos al espectro completo de rayos cósmicos galácticos (iones de alta energía) y eventos solares de eyección de partículas (protones).
El peligro de exposición a la radiación se agrava debido a la duración de las misiones. Además la protección de los lugares que habitarán los exploradores también debe considerarse.

En este orden de ideas, un estudio realizado en 2018 indicó que entre los materiales probados el LiH proporciona la mayor reducción de radiación por gramo por cm2, siendo así uno de los mejores candidatos para ser usado en la protección contra las radiaciones cósmicas. Sin embargo, estos estudios deben ser profundizados.
La obtención de energía a partir del H2 es algo que se ha estudiado desde hace varias decenas de años y ya ha encontrado aplicación para sustituir los combustibles fósiles en los vehículos de transporte.
El H2 puede ser utilizado en celdas de combustible y contribuir con la reducción de la producción de CO2 y NOx, evitando así el efecto invernadero y la contaminación. Sin embargo, aún no se ha encontrado un sistema efectivo para almacenar y transportar H2 de manera segura, con peso liviano, compacto o de pequeño tamaño, que lo almacene rápido y que libere el H2 igualmente rápido.
El hidruro de litio LiH es de los hidruros alcalinos que posee la mayor capacidad de almacenamiento de H2 (12,7 % en peso de H). Libera H2 mediante hidrólisis según la siguiente reacción:
LiH + H2O → LiOH + H2
El LiH suministra 0,254 Kg de hidrógeno por cada Kg de LiH. Además, posee una alta capacidad de almacenamiento por unidad de volumen, lo que significa que es liviano y es un medio compacto para almacenamiento de H2.

Adicionalmente, el LiH se forma más fácilmente que otros hidruros de metales alcalinos y es químicamente estable a temperaturas y presiones ambientales. El LiH puede transportarse desde el fabricante o suplidor al usuario. Luego mediante hidrólisis del LiH se genera el H2 y este se utiliza de forma segura.
El hidróxido de litio LiOH formado puede retornarse al suplidor que regenera el litio mediante electrólisis, para luego volver a producir LiH.
El LiH también ha sido estudiado con éxito para ser usado junto con la hidracina borada para el mismo fin.
El LiH permite la síntesis de hidruros complejos.
Sirve por ejemplo para preparar trietilborohidruro de litio es cual es un potente nucleófilo en reacciones de desplazamiento de haluros orgánicos.
- Sato, Y. and Takeda, O. (2013). Hydrogen Storage and Transportation System through Lithium Hydride Using Molten Salt Technology. In Molten Salts Chemistry. Chapter 22, pages 451-470. Recuperado de sciencedirect.com.
- U.S. National Library of Medicine. (2019). Lithium Hydride. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- Wang, L. et al. (2019). Investigation on the impact of thermal-kernel effect of lithium hydride on the reactivity of nuclear propulsion particle bed reactor. Annals of Nuclear Energy 128 (2019) 24-32. Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Giraudo, M. et al. (2018). Accelerator-Based Tests of Shielding Effectiveness of Different Materials and Multilayers using High-Energy Light and Heavy Ions. Radiation Research 190; 526-537 (2018). Recuperado de ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Lithium hydride: A space age shielding material. Nuclear Engineering and Design 26, 3, February 1974, pages 444-460. Recuperado de sciencedirect.com.
- Simnad, M.T.(2001). Nuclear Reactors: Shielding Materials. In Encyclopedia of Materials: Science and Technology (Second Edition). Pages 6377-6384. Recuperado de sciencedirect.com.
- Hügle, T. et al. (2009). Hydrazine Borane: A Promising Hydrogen Storage Material. J. Am. Chem. Soc. 2009, 131, 7444-7446. Recuperado de pubs.acs.org.
