Peróxido de hidrógeno (H2O2): estructura, propiedades, usos, obtención
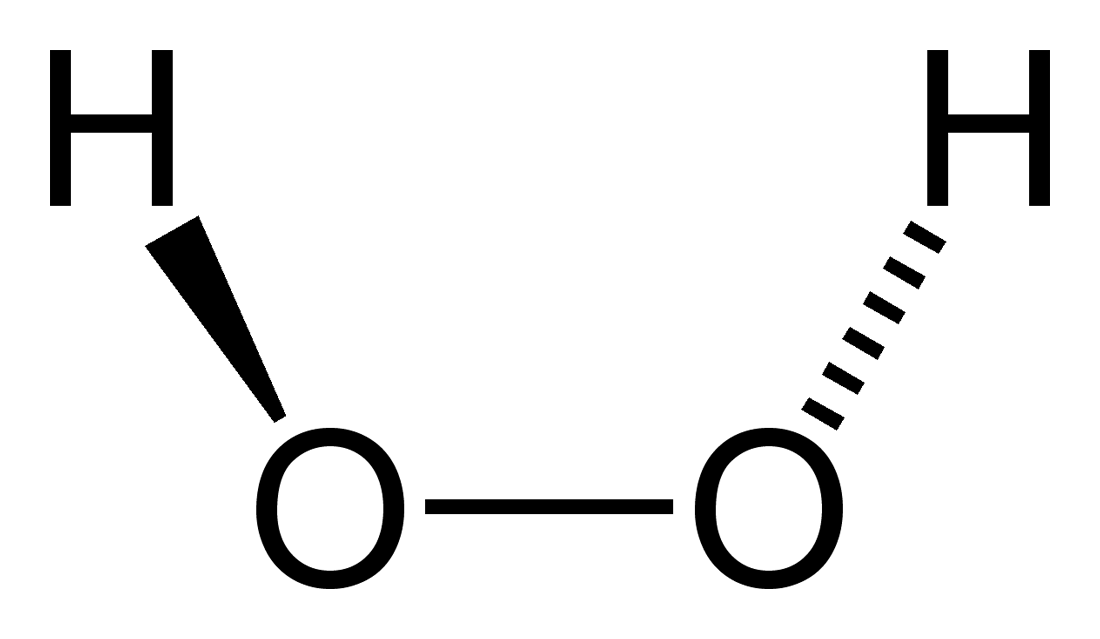
El peróxido de hidrógeno es un compuesto inorgánico cuya fórmula química es H2O2. De todos es el peróxido más sencillo de esta familia de compuestos químicos. Su fórmula estructural es H-O-O-H, siendo este puente interno oxigenado característico para todos los peróxidos.
En 1818, el H2O2 fue identificado por Louies Jacques Thénard, quien preparó un compuesto químico al cual llamó para entonces agua oxigenada. Es un compuesto inestable, se descompone por la exposición a la luz, el calor y algunos metales.
Es un compuesto de gran utilidad que se usa en la desinfección de heridas leves, blanqueamiento del cabello, tratamiento del agua, etc. Aunque puede tener acciones dañinas para el ser humano, se encuentra en todas las células eucariotas de los seres vivos, donde realiza varias funciones beneficiosas.
El peróxido de hidrógeno produce la oxidación de sustancias tóxicas como fenoles, etanol, formaldehido, etc., productos que son eliminados por el hígado y los riñones. Además, contribuye a la destrucción de las bacterias fagocitadas por los leucocitos neutrófilos y macrófagos.
Índice del artículo
- 1 Estructura
- 2 Propiedades
- 2.1 Nombres
- 2.2 Masa molar
- 2.3 Apariencia física
- 2.4 Olor
- 2.5 Sabor
- 2.6 Densidad
- 2.7 Punto de fusión
- 2.8 Punto de ebullición
- 2.9 Solubilidad en agua
- 2.10 Solubilidad
- 2.11 Coeficiente de partición octanol/agua
- 2.12 Presión de vapor
- 2.13 Constante de disociación
- 2.14 pH
- 2.15 Índice de refracción (nD)
- 2.16 Viscosidad
- 2.17 Capacidad calorífica
- 2.18 Calor de vaporización
- 2.19 Estabilidad
- 2.20 Corrosión
- 2.21 Descomposición
- 2.22 Tensión superficial
- 2.23 Reactividad
- 3 Usos
- 4 Obtención
- 5 Riesgos
- 6 Referencias
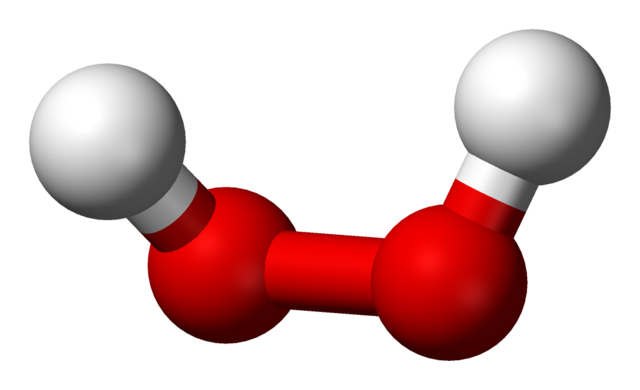
En la imagen superior se aprecia la estructura de la molécula del H2O2 (H-O-O-H), con las esferas rojas correspondiendo a los átomos de oxígeno, y las blancas los átomos de hidrógeno. Nótese que la molécula no es plana, y que tampoco los átomos H se hallan eclipsados en el espacio (uno frente al otro).
Curiosamente, al H2O2 se le dificulta rotar su enlace simple central O-O, por lo que las posiciones de estos H no pueden intercambiarse; uno no bajará mientras el otro sube.
¿Por qué? Porque en los dos átomos de oxígeno hay dos pares libres de electrones, lo cual da un total de ocho electrones muy cercanos y que se repelen entre sí por sus cargas negativas.
Aun así el enlace O-O es susceptible a rotar levemente debido a las interacciones con su entorno.
Por ejemplo, al juntar los dos pulgares, con los dedos índices extendidos y los demás cerrados, como dibujando una cancha, y luego girar los pulgares de tal modo que uno de los dedos índices apunte hacia delante y el otro hacia atrás, se tendrá una representación aproximada del H2O2.
Si un cuerpo toca cualquiera de los dedos índices, los pulgares rotarán en respuesta de esta interacción; sin embargo, inmediatamente regresarán a su posición original debido a las repulsiones electrónicas mencionadas arriba. Estas rotaciones enmarcan pues los aspectos dinámicos de esta molécula.
En el estado líquido el H2O2 logra establecer puentes de hidrógeno (HOOH—O2H2), ya que de lo contrario no se explicaría su alto punto de ebullición (150 ºC) en comparación al del agua.
Una vez pasa a la fase gaseosa, las moléculas H2O2 presumiblemente ya no puede formar tales puentes, debido no solo a la mayor distancia intermolecular, sino que además los átomos de hidrógeno serían los primeros en tocarse en caso de colisiones (esto puede visualizarse recurriendo de nuevo al modelo de los dedos).
Mientras, en fase sólida el ángulo de los planos que establecen los H es de 90º (poner los dedos índices perpendiculares). Ahora los puentes de hidrógeno se tornan aún más importantes y las moléculas del H2O2 se ordenan en un cristal de estructura tetragonal.
sBotella con peróxido de hidrógeno. En las farmacias se consigue con una concentración de 3% m/v. Fuente: Pixnio.
-Peróxido de hidrógeno
-Dioxidano
-Oxidanol
-Ácido perhidróxico
-O-hidroxiol
-Agua oxigenada
34,0147 g/mol
Líquido azul pálido (concentrado) o incoloro. Es ligeramente más viscoso y denso que el agua. Se destila por seguridad a temperaturas bajas y a presión reducida, ya que se descompone por calentamiento en forma explosiva.
Agudo o un olor semejante al ozono.
Amargo
Sólido 1,71 g/cm3
Las densidades de sus disoluciones acuosas dependen de su concentración; por ejemplo, al 27 % tiene una densidad de 1,10 g/cm3, mientras que al 50 %, 1,13 g/cm3
– 0,43 ºC
150,2 ºC. Este valor se ha obtenido por extrapolación, ya que el peróxido de hidrógeno se descompone a temperaturas altas.
Miscible ≥ 100 mg/mL a 25 ºC
Es soluble en éter y alcoholes, pero insoluble en éter de petróleo. Se descompone en agua y oxígeno en muchos solventes orgánicos.
Log P = – 0,43
5 mmHg a 30 ºC.
pKa =11,72
Las soluciones de peróxido de hidrógeno son ligeramente ácidas. Por ejemplo, una al 35% tiene un pH de 4,6; pero al concentrarse a 90%, el pH se torna menos ácido: 5,1.
1,4061
1,245 cPoise a 20 ºC.
1,267 J/g·K (gas)
2,619 J/g·K (liquido)
1,519 J/g·K
Estable bajo las condiciones recomendadas. Lo estabilizan más la adición de acetanilida y sales de estaño.
Corrosivo
Se descompone por exposición a la luz o en presencia de sustancias oxidantes y reductoras. También se descompone por calentamiento. Cuando se decompone libera agua y oxígeno, y se favorece por un incremento del pH y la temperatura, así como con la presencia de la enzima catalasa.
80,4 dinas/cm a 20 ºC
El H2O2 Actúa como agente oxidante en soluciones ácidas del hierro ferroso (Fe2+) a hierro férrico (F3+); también oxida el ion sulfito (SO32-) a ion sulfato (SO42-).
Asimismo puede actuar como agente reductor en presencia soluciones básicas, reduciendo al hipoclorito de sodio (NaOCl) y al permanganato de potasio (KMnO4) con la liberación de oxígeno.
El peróxido de hidrógeno se usa en la industria del papel en el blanqueamiento de la pulpa y el papel, lo cual consume la mayor parte de su producción anual.
El peróxido de hidrógeno es un antiséptico suave para evitar la infección de heridas pequeñas, raspones y quemaduras. También se usa como enjuague bucal y para aliviar la irritación leve de la boca debido a la presencia de aftas bucales o gingivitis.
Se usa además para desinfectar superficies, el interior de las neveras, el agua y combatir el crecimiento bacteriano excesivo en sistemas de agua y en torres de enfriamiento. El peróxido de hidrógeno libera radicales libres de oxígeno, los cuales descomponen a los contaminantes.
El peróxido de hidrógeno se usa en la fabricación de detergentes blanqueadores de las ropas, entre ellos el percarbonato de sodio. Este compuesto es un complejo de carbonato de sodio y peróxido de hidrógeno que al disolverse en el agua se separa en sus componentes.
El peróxido hidrógeno diluido se utiliza en al blanqueamiento del cabello, previamente a su tinción. También se utiliza para blanquear lo dientes, así como parte de una crema dental casera.
El peróxido de hidrógeno se usa como monopropelente o componente oxidante de un cohete bipropolente. Se descompone liberando oxígeno y agua, característica que permitió su uso como propelente.
Se bombea a una celda de reacción con la presencia de un catalizador que acelere dicha descomposición. Durante esta, se produce un vapor de agua a temperatura elevada.
Al ser expulsado el vapor a través de un boquete produce un impulso. El submarino V-80 construido en 1940, usaba en las turbinas oxígeno generado a partir del peróxido de hidrógeno; llamado sistema de turbina de Walter.
Inicialmente el peróxido de hidrógeno fue obtenido industrialmente mediante la hidrólisis del persulfato de amonio, [(NH4)2S2O8] o la electrólisis del bisulfato de amonio, NH4HSO4.
El peróxido de hidrógeno se obtiene industrialmente en la actualidad mediante el uso de la antraquinona. El proceso se realiza en cuatro etapas: hidrogenación, filtración, oxidación, extracción y purificación.
La alquilantroquinona es hidrogenada haciendo pasar el gas hidrogeno a través de un hidrogenador cargado con alúmina y una pequeña cantidad del catalizador (paladio). La temperatura es mantenida a 45 ºC con agitación permanente.
La alquilandroquinona es convertida en alquiloantrahidroquinona y la tetrahidroalquilantrahidroquinona, seleccionándose esta última por su mayor conveniencia para los procedimientos siguientes.
La solución que contiene la antraquinona hidrogenada se filtra para eliminar las trazas del catalizador que pueda contener.
La solución filtrada se oxida haciendo pasar aire a través de ella, formándose el peróxido de hidrógeno de baja pureza.
La solución con el peróxido de hidrógeno atraviesa una columna de extracción líquido-líquido. El agua fluye por la columna, mientras la solución con el peróxido de hidrógeno se bombea por ella.
El agua llega al fondo del extractor con una concentración de peróxido de hidrógeno entre el 25 y 35 % p/p. Luego, se purifica por destilación al vacío, hasta una concentración de peróxido de hidrógeno del 30 %. Finalmente se estabiliza y se almacena.

El peróxido de hidrógeno es un agente corrosivo, por lo que al contacto con la piel produce una irritación severa, además de un blanqueamiento temporal (imagen superior). También puede producir daño ocular, picazón, salpullido, enrojecimiento y formación de ampollas.
Su inhalación produce irritación en la nariz, la garganta y los pulmones. Mientras, la exposición repetida puede producir bronquitis, tos, flema y el acortamiento de la respiración. Y como si no bastara, también genera de dolor de cabeza, vahídos, náuseas y vómitos.
La exposición grave al peróxido de hidrógeno puede producir una acumulación de líquidos en los pulmones, lo que se conoce como un edema pulmonar: condición grave que requiere de pronta atención médica.
La Occupational Safety and Health Administration (OSHA) ha establecido el máximo permisible para el peróxido de hidrógeno de 1 ppm en un ambiente de trabajo en una jornada de 8 horas. Sin embargo, por ser un compuesto mutagénico debe ser reducida la exposición a lo mínimo.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Hydrogen peroxide. Recuperado de: en.wikipedia.org
- William R. Busing and Henri A. Levy. (2004). Crystal and Molecular Structure of Hydrogen Peroxide: A Neutron‐Diffraction Study. doi.org/10.1063/1.1696379
- National Center for Biotechnology Information. (2019). Hydrogen peroxide. PubChem Database. CID=784. Recuperado de: pubchem.ncbi.nlm.nih.gov
- The Editors of Encyclopaedia Britannica. (27 noviembre de 2018). Hydrogen peroxide. Encyclopædia Britannica. Recuperado de: britannica.com
- New Jersey Department of Health. (2016). Hydrogen Peroxide. [PDF]. Recuperado de: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Bioquímica. Tercera Edición. Editorial Pearson Addison Wesley
- Web MD. (2019). Hydrogen peroxide. Recuperado de: webmd.com
