Boro: historia, propiedades, estructura, usos
El boro es un elemento no metálico que encabeza el grupo 13 de la tabla periódica y se representa con el símbolo químico B. Su número atómico es el 5, y es el único elemento no metálico de su grupo; aunque algunos químicos lo consideran un metaloide.
Se presenta como un polvo marrón negruzco, y se encuentra en una proporción 10 ppm con relación a la corteza terrestre. Por lo tanto no es uno de los elementos más abundantes.

Se halla formando parte de varios minerales como el bórax o borato sódico, siendo este el mineral de boro más común. Asimismo están la kurnita, otra forma de borato sódico; la colemanita o borato de calcio; y la ulexita, borato de sodio y calcio.
Los boratos se extraen en Estados Unidos, el Tibet, China y Chile con una producción mundial de aproximadamente dos millones de toneladas por año.
Este elemento posee trece isótopos, siendo los más abundantes el 11B, el cual constituye en peso el 80,1% del boro, y el 10B, que forma el 19,9% restante.
El boro es un oligoelemento esencial para las plantas, interviniendo en la síntesis de algunas proteínas vegetales vitales y contribuye en la absorción de agua. En los mamíferos parece ser necesario para la salud ósea.
Aunque el boro fue descubierto en 1808 por el químico inglés Sir Humphry Davy, y los químicos franceses Jacques Thérnard y Joseph Gay-Lussac, ya desde el principio de nuestra era en la China se usaba el bórax en la elaboración de cerámica de esmalte.
El boro y su compuestos tienen muchos usos y aplicaciones, que van desde su empleo en la conservación de los alimentos, especialmente la margarina y el pescado, hasta su uso en el tratamiento de tumores cancerosos del cerebro, la vejiga, la próstata y otros órganos.
El boro es poco soluble en agua, pero sus compuestos sí lo son. Esto podría ser un mecanismo de concentración del boro, así como una fuente de intoxicación con el elemento.
Índice del artículo
- 1 Historia
- 2 Propiedades
- 2.1 Descripción física
- 2.2 Masa molar
- 2.3 Punto de fusión
- 2.4 Punto de ebullición
- 2.5 Densidad
- 2.6 Calor de fusión
- 2.7 Calor de vaporización
- 2.8 Capacidad calórica molar
- 2.9 Energía de ionización
- 2.10 Electronegatividad
- 2.11 Radio atómico
- 2.12 Volumen atómico
- 2.13 Conductividad térmica
- 2.14 Resistividad eléctrica
- 2.15 Dureza
- 2.16 Reactividad
- 3 Estructura y configuración electrónica del boro
- 4 Obtención
- 5 Usos
- 6 Riesgos y precaución
- 7 Referencias
Desde épocas remotas el hombre ha usado a los compuestos del boro en diversas actividades. El bórax, un mineral conocido como tincal, era usado en China en el año 300 d.C. en la elaboración de cerámicas de esmalte.
El alquimista persa Rhazes (865-925) hizo la primera mención de los compuestos de boro. Rhazes clasificó los minerales en seis clases, una de las cuales la constituían los boracios que incluía el boro.
Agricola, alrededor de 1600, informó del uso del bórax como flujo en la metalurgia. En 1777, se reconoció la presencia del ácido bórico en una corriente de aguas termales cerca de Florencia.
Humphry Davy, mediante la electrólisis de una solución de bórax, observó la acumulación de un precipitado negro en uno de los electrodos. También calentó óxido de boro (B2O3) con potasio, produciendo un polvo marrón negruzco que era la forma conocida del boro.
Gay-Lussac y Thénard redujeron el ácido bórico a altas temperaturas en presencia de hierro para producir de boro. También mostraron el proceso inverso, es decir, donde el ácido bórico es un producto de la oxidación del boro.
Jöns Jakob Berzelius (1827) logró la identificación del boro como un elemento nuevo. En 1892, el químico francés Henri Moissan logró producir boro con un 98% de pureza. Aunque, se señala que el boro fue producido en forma pura por el químico estadounidense Ezekiel Weintraub, en el año 1909.
Sólido cristalino o polvo amorfo color negro-marrón.
10,821 g/mol.
2076 ºC.
3927 ºC.
-Líquido: 2,08 g/cm3.
-Cristalino y amorfo a 20 ºC: 2,34 g/cm3.
50,2 kJ/mol.
508 kJ/mol.
11.087 J/(mol·K)
-Primer nivel: 800.6 kJ/mol.
-Segundo nivel: 2.427 kJ/mol.
-Tercer nivel: 3.659,7 kJ/mol.
2,04 en la escala Pauling.
90 pm (empírico).
4,16 cm3/mol.
27,4 W/m.K
~ 106 Ω.m (a 20ºC).
El boro a altas temperaturas es un buen conductor eléctrico, pero a temperatura ambiental se convierte casi en un aislante.
~ 9,5 en la escala de Mohs.
El boro no es afectado por el ácido clorhídrico a temperatura de ebullición. Sin embargo, es convertido por el ácido nítrico en caliente a ácido bórico (H3BO3). El boro químicamente se comporta como un no metal.
Reacciona con todos los halógenos para dar trihaluros, altamente reactivos. Estos tienen la fórmula general BX3, donde X representa el halógeno.
Se combina con varios elementos para originar boruros. Algunos de ellos se encuentran entre las sustancias de mayor dureza; por ejemplo, nitruro de boro (BN). El boro se combina con el oxígeno para formar trióxido de boro.
Antes de abordar las estructuras del boro (cristalinas o amorfas) es indispensable tener en mente cómo pueden enlazarse sus átomos. El enlace B-B es en esencia covalente; no solo eso, sino que debido a que naturalmente los átomos de boro presentan deficiencia electrónica, intentarán surtirla en sus enlaces de un modo u otro.
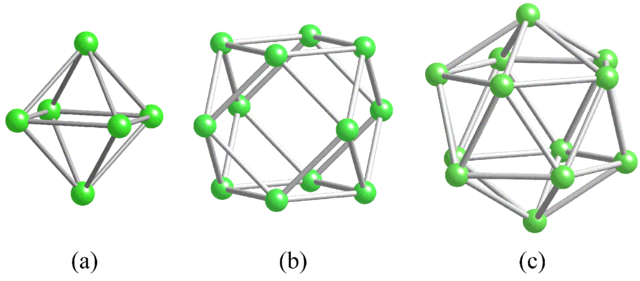
En el boro se observa un tipo especial de enlace covalente: el de tres centros y dos electrones, 3c2e. Aquí tres átomos de boro comparten dos electrones, y definen un triángulo, una de las tantas caras encontradas en sus poliedros estructurales (imagen superior).
De izquierda a derecha tenemos: octaedro (a, B6), cuboctaedro (b, B12), y el isocasedro (c, B12 también). Todas estas unidades comparten una característica: son pobres en electrones. Por lo tanto, tienen a enlazarse covalentemente entre ellas mismas; y el resultado es una fiesta de enlaces sorprendentes.
En cada triángulo de esos poliedros está presente el enlace 3c2e. De lo contrario no podría explicarse cómo el boro, capaz de formar apenas tres enlaces covalentes de acuerdo la Teoría del Enlace de Valencia, pueda tener hasta cinco enlaces en dichas unidades poliédricas.
Las estructuras del boro consisten entonces en un arreglo y repetición de estas unidades que terminan definiendo un cristal (o un sólido amorfo).

Puede haber otras unidades poliédricas de boro, así como una compuesta solamente por dos átomos, B2; una “línea” de boro que obligatoriamente debe enlazarse a otros átomos a raíz de su alta deficiencia electrónica.
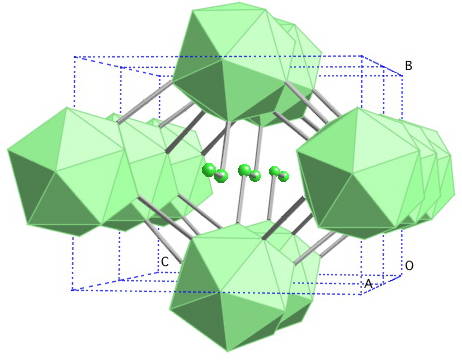
El icosaedro es de lejos la unidad preferida del boro; la que le sienta mejor. En la imagen superior, por ejemplo, se aprecia cómo estas unidades B12 se entrelazan para definir el cristal romboédrico del Boro-α.
Si se quisiera aislar uno de esos icosaedros sería una tarea complicada, pues su deficiencia electrónica les obliga a definir un cristal donde cada uno aporta los electrones que necesitan los otros vecinos.
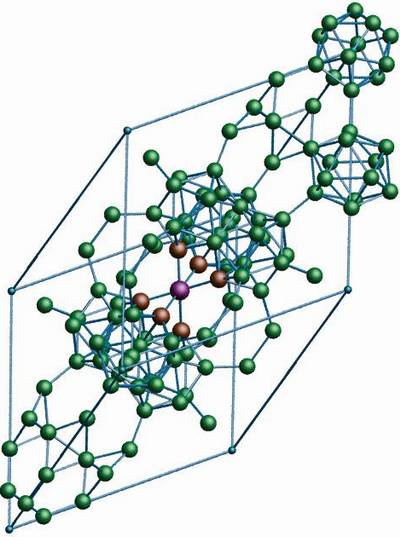
El alótropo boro β-romboédrico, como su nombre de por sí ya indica, posee cristales romboédricos al igual que el boro-α; sin embargo difiere en sus unidades estructurales. Pareciera una nave extraterrestre hecha con átomos de boro.
Si se observa cuidadosamente podrá divisarse las unidades icosaédricas de manera discretas y fusionadas (en el centro). Hay además unidades B10 y átomos solitarios de boro que actúan como puente para las unidades mencionadas. De todos, este es el alótropo de boro más estable.
En este alótropo de boro se coordinan las unidades B2 y B12. El B2 presenta tanta deficiencia electrónica que de hecho retira electrones del B12 y hay, por lo tanto, un carácter iónico dentro de este sólido. Es decir, que no solo están unidos covalentemente, sino que hay atracción electrostática de tipo [B2–][B12+].
El boro-γ cristaliza en una estructura tipo sal gema, la misma que para el NaCl. Se obtiene sometiendo otros alótropos de boro a altas presiones (20 GPa) y temperaturas (1800°C), para después permanecer estable en condiciones normales. Su estabilidad de hecho compite con la del boro β-romboédrico.
Otros alótropos del boro consisten de agregados de átomos de B como si estuvieran unidos por un enlace metálico, o como si fueran cristales iónicos; es decir, se trata de un boro cúbico.
Asimismo, y no menos importante, está el boro amorfo, cuya disposición de unidades B12 es aleatoria y desordenada. Se presenta como un polvo fino o sólido vidrioso de colores oscuros y marrones opacos.

Y finalmente está el alótropo más novedoso y estrambótico del boro: el borofenos (imagen superior). Consiste de una mono capa de átomos de boro; sumamente delgada y análoga al grafeno. Nótese que conserva los famosos triángulos, característico de la deficiencia electrónica que sufre sus átomos.
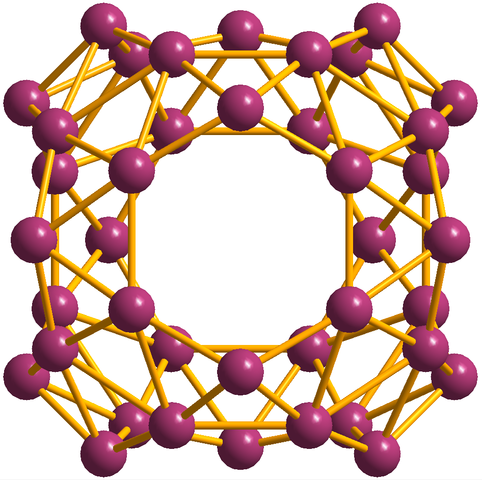
Además de los borofenos, del cual el B36 es el más simple y pequeño, están también los clústeres de boro. El borosfereno (imagen de abajo) consiste de una jaula esférica parecida a un balón de cuarenta átomos de boro, B40; pero en lugar de tener bordes lisos, son abruptos e irregulares:
La configuración electrónica del boro es:
[He] 2s2 2p1
Tiene por tanto tres electrones de valencia. Le faltan cinco más para completar su octeto de valencia, y apenas puede formar tres enlaces covalentes; necesitaría de un cuarto enlace dativo para completar su octeto. El boro puede perder sus tres electrones para adquirir un estado de oxidación de +3.
El boro se aísla mediante la reducción del ácido bórico con el magnesio o el aluminio; método semejante al usado por Gay-Lussac y Thénard. Tiene la dificultad de la contaminación del boro con los boruros de esos metales.
Una muestra de alta pureza puede obtenerse por reducción en fase gaseosa del tricloruro de boro, o tribromuro, con hidrógeno sobre filamentos calentados eléctricamente de tántalo.
Un boro de alta pureza es preparado mediante la descomposición a temperaturas elevada del diborano, seguida de una purificación mediante la fusión de zona o procesos Czocharalski.
El boro elemental ha sido utilizado en el endurecimiento del acero. En una aleación con el hierro que contiene un entre el 0,001 al 0,005 % de boro. También se usa en la industria no ferrosa, usualmente como desoxidante.
Además el boro es usado como desgasificante en aleaciones a base de cobre y cobre de alta conductancia. En la industria de los semiconductores, se agrega cuidosamente pequeñas cantidades de boro como agente dopante del silicio y el germanio.
El óxido de boro (B2O3) es mezclado con sílice para elaborar un vidrio resistente al calor (vidrio de borosilicato), usado en utensilios de cocina y ciertos equipos de laboratorio.
El carburo de boro (B4C) es una sustancia extremadamente dura que se utiliza como abrasivo y agente de refuerzo en materiales compuestos. El boruro de aluminio (AlB12) se emplea como sustituto del polvo de diamante para el esmerilado y pulido.
El boro se usa en aleaciones, por ejemplo en los imanes de tierras raras, haciendo aleación con el hierro y el neodimio. Los imanes formados se utilizan en la fabricación de micrófonos, interruptores magnéticos, auriculares y aceleradores de partículas.
La capacidad del isótopo boro-10 (10B) para atrapar neutrones, emitiendo radiaciones tipo α ha sido utilizada para el tratamiento de los tumores cerebrales en una técnica conocida como Terapia de Captura de Neutrones de Boro (BNCT).
El 10B en forma de compuestos es acumulado en el tumor canceroso. Posteriormente se irradia la zona tumoral con neutrones. Estos interaccionan con 10B, lo que provoca la emisión de partículas α. Estas partículas tienen un efecto biológico relativo alto y debido a su gran tamaño tienen poco alcance.
Por lo que la acción destructiva de las partículas α queda confinada en las células tumorales, realizando su destrucción. BNCT también es usado en el tratamiento de tumores cancerosos de cuello, hígado, la vejiga y la próstata.
Una pequeña cantidad de boro en forma de ácido bórico o borato, es necesario para el crecimiento de muchas plantas. Una deficiencia del boro se manifiesta en crecimiento deforme de las plantas; el “corazón marrón” de las verduras; y la “podredumbre seca” de la remolacha azucarera.
El boro podría ser necesario en pequeñas cantidades para mantener la salud ósea. Hay estudios que señalan que la falta de boro estaría involucrada en la generación de artritis. También intervendría en funciones cerebrales como la memoria y la coordinación ojo-mano.
Algunos expertos señalan que se debería incluir 1,5 a 3 mg de boro en la dieta diaria.
El boro, el óxido de boro, el ácido bórico y los boratos, son considerados como no tóxicos. El LD50 para animales es de 6 g de boro/kg de peso corporal, mientras las sustancias con un LD50 mayor a 2 g/kg de peso corporal, son consideradas como no tóxicas.
Por otro lado, el consumo de más de 0,5 mg/día de boro durante 50 días causa problemas digestivos menores, sugerentes de toxicidad. Algunos reportes señalan que un exceso en la ingesta de boro puede afectar el funcionamiento del estómago, el hígado, los riñones y el cerebro.
Asimismo, se ha señalado efectos irritantes de corta duración en la nasofaringe, vías respiratorias superiores y los ojos por la exposición al boro.
Los reportes acerca de la toxicidad del boro son escasos y en muchos casos, la toxicidad se presenta a dosis muy elevadas, superiores a las que está expuesta la población general.
La recomendación es vigilar el contenido de boro de los alimentos, especialmente las verduras y las frutas. Los organismos gubernamentales de la salud deben de vigilar que la concentración de boro del agua no sobrepase los límites permitidos.
Los trabajadores expuestos al polvo que contiene boro deben usar máscaras que protejan las vías respiratorias, guantes y botas especiales.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Allotropes of boron. Recuperado de: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Lecture 5b. Structure of the elements (non-metals, B, C). The Department of Chemistry, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Recuperado de: chem.uwimona.edu.jm
- Manisha Lalloo. (28 de enero de 2009). Ultra-pure boron structure discovered. Chemistry World. Recuperado de: chemistryworld.com
- Bell Terence. (16 de diciembre de 2018). A profile of the metal boron. Recuperado de: thebalance.com
- The Editors of Encyclopaedia Britannica. (2019). Boron. Recuperado de: britannica.com
- Agency for Toxic Substances and Disease Registry. (2010). ToxFAQs™ sobre el boro. [PDF]. Recuperado de: atsdr.cdc.gov
- Helmenstine, Anne Marie, Ph.D. (06 de febrero de 2019). Boron Chemical & Physical Properties. Recuperado de: thoughtco.com
