Reacción endotérmica: características, ecuaciones y ejemplos
Una reacción endotérmica es aquella que para tener lugar debe absorber energía, en forma de calor o radiación, de sus alrededores. Generalmente, aunque no siempre, pueden reconocerse por un descenso de la temperatura en su entorno; o por el contrario, necesitan de una fuente de calor, como la obtenida por una llama ardiente.
La absorción de energía o calor es lo que tienen en común todas las reacciones endotérmicas; la naturaleza de las mismas, así como las transformaciones involucradas, son muy diversas. ¿Cuánto calor deben absorber? La respuesta depende de su termodinámica: la temperatura a la que la reacción ocurre espontáneamente.

Por ejemplo, una de las reacciones endotérmicas más emblemáticas es el cambio de estado del hielo a agua líquida. El hielo necesita absorber calor hasta que su temperatura alcance los 0ºC aproximadamente; a esa temperatura su fusión se vuelve espontánea, y el hielo absorberá hasta que se haya fundido por completo.
En espacios calurosos, como en las orillas de una playa, las temperaturas son más elevadas y por tanto el hielo absorbe calor a mayor rapidez; es decir, se derrite a mayor velocidad. El derretimiento de los glaciares es un ejemplo de una reacción endotérmica indeseable.
¿Por qué ocurre de esta manera? ¿Por qué el hielo no puede presentarse como un sólido caliente? La respuesta está en la energía cinética promedio de las moléculas de agua en ambos estados, y cómo interaccionan entre sí mediante sus puentes de hidrógeno.
En el agua líquida, sus moléculas tienen mayor libertad de movimiento que en el hielo, donde vibran estacionariamente en sus cristales. Para moverse, las moléculas deben absorber energía de tal manera que sus vibraciones rompan los fuertes puentes de hidrógeno direccionales en el hielo.
Por esta razón el hielo absorbe calor para derretirse. Para que exista un “hielo caliente” los puentes de hidrógeno tendrían que ser anormalmente fuertes para fundirse a una temperatura muy por encima de los 0ºC.
Índice del artículo
- 1 Características de una reacción endotérmica
- 2 Ecuaciones
- 3 Ejemplos de reacciones endotérmicas comunes
- 3.1 Evaporación del hielo seco
- 3.2 Horneado de panes o cocinar alimentos
- 3.3 Los baños de sol
- 3.4 Reacción del nitrógeno atmosférico y formación de ozono
- 3.5 Electrólisis del agua
- 3.6 Fotosíntesis
- 3.7 Disoluciones de algunas sales
- 3.8 Descomposiciones térmicas
- 3.9 Cloruro de amonio en agua
- 3.10 Triosulfato de sodio
- 3.11 Motores de coches
- 3.12 Líquidos hirviendo
- 3.13 Cocinar un huevo
- 3.14 Cocción de alimentos
- 3.15 Calentamiento de alimentos en el microondas
- 3.16 Moldeamiento del vidrio
- 3.17 Consumo de una vela
- 3.18 Limpieza con agua caliente
- 3.19 Esterilización por calor de alimentos y otros objetos
- 3.20 Combate de infecciones con fiebre
- 3.21 Evaporación de agua
- 4 Referencias
El cambio de estado no es propiamente una reacción química; sin embargo, sucede lo mismo: el producto (el agua líquida) tiene mayor energía que el reactante (hielo). Esta es la principal característica de una reacción o proceso endotérmico: los productos son más energéticos que los reactivos.
Aunque esto es verdad, no significa que los productos necesariamente deban ser inestables. En el caso que sí lo sea, la reacción endotérmica deja de ser espontánea bajo toda condición de temperatura o presión.
Considerese la siguiente ecuación química:
A + Q => B
Donde Q representa calor, expresado usualmente con las unidades de joule (J) o calorías (cal). Como A absorbe calor Q para transformarse en B, se dice entonces que se trata de una reacción endotérmica. Siendo así, B posee más energía que A, y debe absorber la energía suficiente para lograr su transformación.
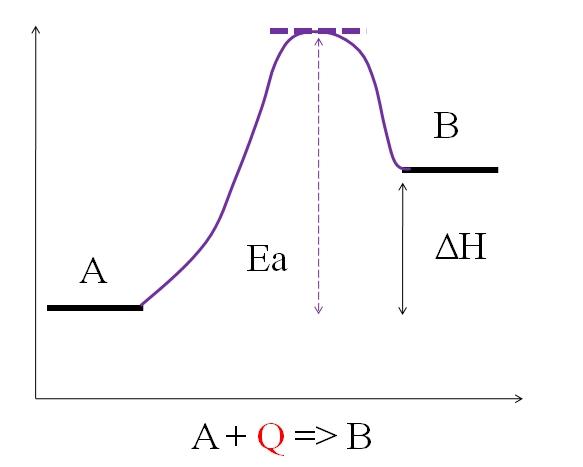
Como puede verse en el diagrama superior, A tiene menor energía que B. La cantidad de calor Q que absorbe A es tal que vence la energía de activación (la energía necesaria para alcanzar la cima morada con techo punteado). La diferencia de energía entre A y B es lo que se conoce como entalpía de la reacción, ΔH.
Todas las reacciones endotérmicas tienen en común el diagrama anterior, ya que los productos son más energéticos que los reactivos. Por lo tanto, la diferencia de energía entre ellos, ΔH, es siempre positivo (HProducto-HReactivo > 0). Al ser esto cierto, debe haber una absorción de calor o energía de los alrededores para surtir esta necesidad energética.
¿Y cómo se interpretan tales expresiones? En una reacción química siempre se rompen enlaces para crear otros. Para romperlos, es necesaria la absorción de energía; esto es, se trata de un paso endotérmico. Mientras, la formación de los enlaces implica estabilidad, por lo que es un paso exotérmico.
Cuando los enlaces formados no brindan una estabilidad equiparable a la cantidad de energía requerida para romper los enlaces viejos, se está ante una reacción endotérmica. Es por ello que se necesita energía adicional para promover el rompimiento de los enlaces más estables en los reactivos.
Por otro lado, en las reacciones exotérmicas ocurre lo contrario: se libera calor, y ΔH es 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
Aunque no aplica para todas las reacciones endotérmicas, varias de ellas ocasionan un descenso de la temperatura de sus alrededores. Esto se debe a que de algún lado proviene el calor absorbido. En consecuencia, si dentro de un recipiente se llevara a cabo la conversión de A y B, este se enfriaría.
Mientras más endotérmica sea la reacción, más frío se tornará el recipiente y sus alrededores. De hecho, algunas reacciones incluso son capaces de formar una delgada cubierta de hielo, como si hubieran salido de un refrigerador.
No obstante, hay reacciones que de este tipo que no enfrían sus alrededores. ¿Por qué? Porque el calor de los alrededores es insuficiente; es decir, no aporta el Q (J, cal) necesario que se escribe en las ecuaciones químicas. Por lo tanto, es aquí cuando entra el fuego o la radiación ultravioleta.
Puede surgir una pequeña confusión entre ambos escenarios. Por un lado, el calor de los alrededores basta para que la reacción prosiga espontáneamente, y se observa un enfriamiento; y por el otro, se necesita de más calor y se recurre a un método eficiente de calentamiento. En ambos casos sucede lo mismo: se absorbe energía.
¿Cuáles son las ecuaciones pertinentes en una reacción endotérmica? Como ya se explicó, el ΔH debe ser positivo. Para calcularlo, se considera primero la siguiente ecuación química:
aA + bB => cC + dD
Donde A y B son las sustancias reactantes, y C y D son los productos. Las letras en minúsculas (a, b, c y d) son los coeficientes estequiométricos. Para calcular el ΔH de esta reacción genérica se aplica la siguiente expresión matemática:
ΔHProductos– ΔHReactivos = ΔHrxn
Se puede proceder directamente, o hacer los cálculos por separado. Para ΔHProductos debe calcularse la siguiente suma:
c ΔHfC + d ΔHfD
Donde ΔHf es la entalpía de formación de cada sustancia involucrada en la reacción. Por convención, las sustancias en sus formas más estables tienen ΔHf=0. Por ejemplo, las moléculas de O2 y H2, o un metal sólido, tienen ΔHf=0.
El mismo cálculo se hace ahora para los reactantes, ΔHReactivos:
a ΔHfA + b ΔHfB
Pero como la ecuación dice que ΔHReactivos debe restársele a ΔHProductos, entonces la suma anterior debe multiplicarse por -1. Así se tiene:
c ΔHfC + d ΔHfD – (a ΔHfA + b ΔHfB)
Si el resultado de este cálculo es un número positivo, entonces se trata de una reacción endotérmica. Y si da negativo, es una reacción exotérmica.

Quien haya visto alguna vez aquellos vapores blancos emanando de un carrito de helados ha presenciado uno de los ejemplos más comunes de una “reacción” endotérmica.
Más allá de unos helados estos vapores desprendidos de unos sólidos blancos, llamados hielos secos, también han formado parte de los escenarios para crear el efecto de neblina. Este hielo seco no es más que dióxido de carbono sólido, el cual al absorber la temperatura y ante la presión externa comienza a sublimarse.
Un experimento para un público infantil sería el de rellenar y sellar una bolsa con hielo seco. Pasado un tiempo, esta terminará por inflarse a causa del CO2 gaseoso, que genera trabajo o presiona las paredes internas de la bolsa en contra de la presión atmosférica.

El horneado de panes es un ejemplo de una reacción química, ya que ahora sí hay cambios químicos a causa del calor. Quien haya olido el aroma de los panes recién horneados sabe que está ocurriendo una reacción endotérmica.
La masa y todos sus ingredientes, necesitan del calor del horno para llevar a cabo todas las transformaciones, indispensables para convertirse en el pan y exhibir sus características típicas.
Además de los panes, la cocina está repleta de ejemplos de reacciones endotérmicas. Quien cocine lidia con ellas diariamente. El cocinar pasta, ablandar los granos, calentar los granos de maíz, cocer huevos, sazonar las carnes, hornear un pastel, preparar té, calentar unos emparedados; cada uno de esas actividades son reacciones endotérmicas.

Por simple y común que puedan parecer, los baños de sol que se toman ciertos reptiles, como las tortugas y cocodrilos, entran en la categoría de reacciones endotérmicas. Las tortugas absorben el calor del sol para regular la temperatura de su organismo.
Sin el sol, retienen el calor del agua para mantenerse calientes; lo que termina en el enfriamiento del agua de sus estanques o peceras.

El aire se compone principalmente de nitrógeno y oxígeno. Durante las tormentas eléctricas, se libera una energía tal que puede romper los fuertes enlaces que mantienen unidos los átomos de nitrógeno en la molécula de N2:
N2 + O2 + Q => 2NO
Por otro lado, el oxígeno puede absorber radiación ultravioleta para convertirse en ozono; alótropo del oxígeno que es muy beneficioso en la estratósfera, pero perjudicial para la vida al nivel de tierra. La reacción es:
3O2 + v => 2O3
Donde v significa radiación ultravioleta. El mecanismo detrás de esa simple ecuación es muy complejo.
La electrólisis hace uso de la energía eléctrica para separar una molécula en sus elementos o moléculas formadoras. Por ejemplo, en la electrólisis del agua se generan dos gases: hidrógeno y oxígeno, cada uno en electrodos diferentes:
2H2O => 2H2 + O2
Asimismo, el cloruro de sodio puede sufrir esta misma reacción:
2NaCl => 2Na + Cl2
En un electrodo se verá la formación de sodio metálico, y en el otro, burbujas verdosas de cloro.

Las plantas y árboles necesitan absorber la luz solar como suministro energético para sintetizar sus biomateriales. Para esto utiliza como materia prima el CO2 y el agua, los cuales mediante una serie larga de pasos, se convierten en glucosa y otros azúcares. Además, se forma oxígeno, el cual se libera de las hojas.
Si se disuelve cloruro de sodio en agua, no se notará ningún cambio apreciable en la temperatura externa del vaso o recipiente.
Algunas sales, como el cloruro de calcio, CaCl2, aumentan la temperatura del agua como producto de la gran hidratación de los iones Ca2+. Y otras sales, como el nitrato o cloruro de amonio, NH4NO3 y NH4Cl, disminuyen la temperatura del agua y se enfrían sus alrededores.
En las aulas suelen hacerse experimentos caseros disolviendo algunas de estas sales para demostrar lo que es una reacción endotérmica.
El descenso de la temperatura se debe a que la hidratación de los iones NH4+ no está favorecida frente a la disolución de los arreglos cristalinos de sus sales. En consecuencia, las sales absorben calor del agua para permitir que los iones sean solvatados.
Otra reacción química que suele ser muy común para demostrar esto es la siguiente:
Ba(OH)2·8H2O + 2NH4NO3 => Ba(NO3)2 + 2NH3 +10H2O
Nótese la cantidad de agua formada. Al mezclar ambos sólidos, se obtiene una disolución acuosa de Ba(NO3)2, con olor a amoníaco, y con un descenso de temperatura tal que literalmente congela la superficie externa del recipiente.
Una de las descomposiciones térmicas más comunes es la del bicarbonato de sodio, NaHCO3, para producir CO2 y agua al calentarse. Muchos sólidos, entre ellos los carbonatos, suelen descomponerse para liberar CO2 y el óxido correspondiente. Por ejemplo, la descomposición del carbonato de calcio es la siguiente:
CaCO3 + Q => CaO + CO2
Lo mismo sucede con los carbonatos de magnesio, estroncio y bario.
Es importante resaltar que una descomposición térmica es diferente a una combustión. En la primera no hay presencia de ignición ni se libera calor, mientras que en la segunda sí; es decir, la combustión es una reacción exotérmica, aun cuando necesita de una fuente de calor inicial para tener lugar o darse espontáneamente.
Cuando se disuelve una pequeña cantidad de cloruro de amonio (NH4Cl) en agua en un tubo de ensayo, el tubo se vuelve más frío que antes. Durante esta reacción química, el calor se absorbe del entorno.
Cuando los cristales de tiosulfato de sodio (Na2S2O3.5H2O), comúnmente llamados hipo, se disuelven en agua, se produce un efecto de enfriamiento.
La quema de gasolina o diesel en los motores de los automóviles, camiones, tractores o autobuses produce energía mecánica, que se utiliza en la circulación de estos vehículos.
Al poner un líquido al calor, este gana energía y pasa a un estado gaseoso.
Al aplicar calor, las proteínas del huevo se desnaturalizan formando la estructura sólida que usualmente se ingiere.
En general, siempre al cocinar con calor para cambiar las propiedades de los alimentos, están ocurriendo reacciones endotérmicas.
Estás reacciones son las que causan que los alimentos se vuelvan más suaves, generen masas maleables, liberen los componentes que contienen, entre otras cosas.
Por la radiación de microondas, las moléculas de agua en los alimentos absorben energía, comienzan a vibrar y aumentan la temperatura de la comida.
La absorción de calor por parte del vidrio flexibiliza sus uniones haciendo que su forma sea más fácil de cambiar.
La cera de las velas se derrite al absorber el calor de la llama, cambiando su forma.
Al utilizar agua caliente para limpiar objetos que han sido manchados con grasa, como ollas o la ropa, la grasa se vuelva más liquida y es más fácil de remover.
Al calentar objetos o alimentos, los microorganismos que estos contienen también aumentan su temperatura.
Cuando mucho calor es suministrado, reacciones dentro de las células microbianas ocurren. Muchas de estas reacciones, como el rompimiento de enlaces o la desnaturalización de proteínas, terminan matando los microorganismos.
Cuando una fiebre se manifiesta, es porque el cuerpo produce el calor necesario para matar las bacterias y virus que causan infecciones y generan enfermedades.
Si el calor generado es mucho y la fiebre alta, las células del cuerpo también son afectadas y se corre riesgo de muerte.
Cuando el agua se evapora y se transforma en vapor, es por el calor que recibe del entorno. A medida que la energía térmica es recibida por cada molécula de agua, su energía de vibración aumenta hasta el punto en que puede moverse libremente, creando vapor.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2018). Endothermic process. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27 de diciembre de 2018). Endothermic Reaction Examples. Recuperado de: thoughtco.com
- Khan Academy. (2019). Endothermic vs. exothermic reactions. Recuperado de: khanacademy.org
- Serm Murmson. (2019). What Happens on the Molecular Level During an Endothermic Reaction? Hearst Seattle Media. Recuperado de: education.seattlepi.com
- QuimiTube. (2013). Cálculo de la entalpía de reacción a partir de las entalpías de formación. Recuperado de: quimitube.com
- Quimicas.net (2018). Ejemplos de Reacción Endotérmica. Recuperado de:
quimicas.net.
