Cloruro de calcio (CaCl2): estructura, propiedades, síntesis, usos
¿Qué es el cloruro de calcio?
El cloruro de calcio (CaCl2) es una sal inorgánica compuesta de calcio, metal alcalinotérreo y halógeno cloro. En ese compuesto se dan varias interacciones electrostáticas que definen la apariencia externa de sus cristales y el resto de sus propiedades físicas.
Asimismo, está siempre acompañado por moléculas de agua, formando hidratos de fórmulas generales CaCl2·xH2O, con x=0, 1, 2, 4 y 6. Cuando x=0, la sal carece de agua y es anhídrida, como indica su fórmula química mencionada anteriormente.
En la imagen superior se ilustran unas porciones sólidas de CaCl2. En condiciones de escasa humedad, es posible mantener la sal anhídrida libre de agua, aunque su tendencia natural es absorberla hasta disolverse (delicuescencia).
Fórmula
Su fórmula química es CaCl2: expresa que por cada ion Ca2+ hay dos iones Cl– que neutralizan la carga positiva. El metal calcio —del grupo 2 de la tabla periódica (Sr. Becambara)— cede sus dos electrones a cada átomo de cloro, elemento del grupo 17.
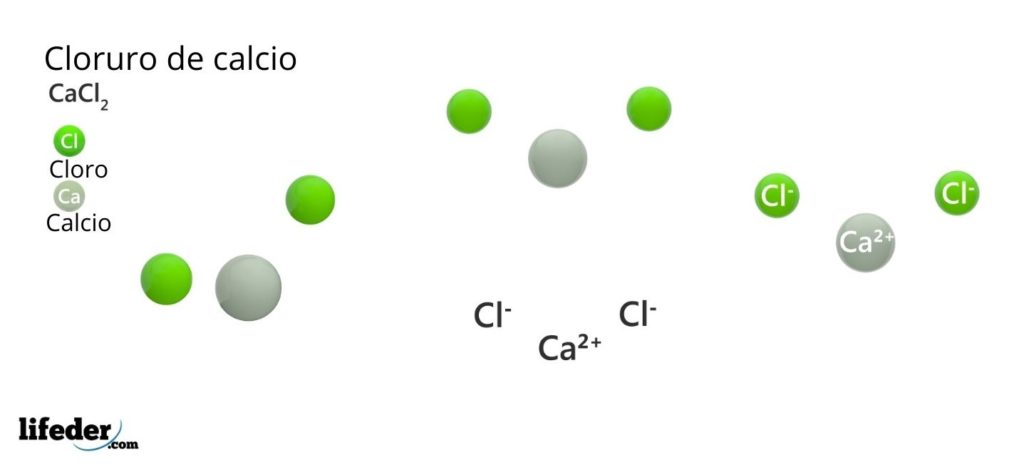
Estructura del cloruro de calcio
En la imagen superior está ilustrada la estructura de CaCl2 anhídrido. Las esferas verdes corresponden a los iones Cl–, mientras que las blancas a los iones Ca2+. Estas esferas se arreglan en un paralelepípedo, que no es más que la celda unitaria ortorrómbica de los cristales.
La estructura puede dar la falsa idea de que el calcio predomina; sin embargo, si se reprodujeran más repeticiones de la celda unitaria quedaría clara la mayor abundancia de las esferas verdes: los iones Cl–.
Por otro lado, los iones Ca2+ tienen radios iónicos más pequeños que los iones Cl–. Esto es debido a que, cuando pierden electrones, los núcleos de los átomos ejercen mayor fuerza atractiva sobre las capas electrónicas externas, lo que reduce el radio iónico.
En el caso del Cl–, este posee un electrón adicional que no puede ser atraído con la misma fuerza, aumentando en consecuencia su radio iónico.
Geometría molecular y complejos acuosos de calcio
En el centro del paralelepípedo el Ca2+ está rodeado de seis Cl–. Cuatro de estos yacen en un plano cuadrado y los otros dos están ubicados perpendicularmente (las esferas verdes más apartadas de la esfera blanca).
Como resultado del arreglo de estos iones, en torno al Ca2+ se “arma” un octaedro, asignándole por tanto una geometría molecular octaédrica.
Considerando cómo están dispuestas las esferas verdes, una molécula de agua puede sustituir una de estas, lo cual ocurre con el CaCl2·H2O, posiblemente en el plano cuadrado. Este hecho modifica la estructura cristalina y, a medida que el agua reemplaza las esferas verdes, más cambia el arreglo de los iones.
Cuando todos los iones Cl– son reemplazados por moléculas de agua, se forma el hidrato CaCl2·6H2O. En este punto el octaedro es “acuoso” y las moléculas ahora son capaces de interaccionar entre ellas por puentes hidrógeno (Ca2+ OH-H—OH2).
Consecutivamente, el calcio puede aceptar aún más moléculas de agua sin alterar la proporción establecida. Esto quiere decir que el CaCl2·6H2O puede adoptar otras estructuras complejas, hasta el punto de considerarse polímeros cristalinos de calcio y agua.
Sin embargo, estas estructuras son menos estables que aquella erigida por las interacciones electrostáticas (Ca2+ y Cl–) de la sal anhídrida.
Usos/aplicaciones del cloruro de calcio
Las aplicaciones principales del cloruro de calcio son:
- Evita el congelamiento del agua durante el invierno. El cloruro de calcio genera mucho calor al disolverse y luego, al aumentar la temperatura, se produce la fusión del hielo. Por esta razón se utiliza para disminuir el riesgo de la circulación de las personas y los vehículos durante la estación fría.
- Ayuda a controlar el polvo en las carreteras sin pavimentar.
- Acelera la velocidad de secado del concreto una vez vertido.
- Los líquidos de CaCl2 aumentan la eficiencia de la perforación para la extracción de gas de sus depósitos subterráneos, así como la del petróleo.
- Se adiciona a las piscinas para disminuir la erosión sufrida por el concreto de sus paredes. El calcio sedimentado cumple esta función.
- Debido a que es una sal higroscópica, el cloruro de calcio puede ser utilizado como disecante, pudiendo bajar la humedad del aire que lo rodea y, por ende, de las sustancias en contacto con ese aire.
- Es utilizado como conservante en algunos alimentos, así como aditivo en varios estos, tales como las bebidas energéticas usadas por los deportistas, quesos, cervezas, etc.
- En la práctica médica también tiene utilidad en el tratamiento de la depresión causada por una sobredosis de sulfato de magnesio, así como en el envenenamiento con plomo.
Síntesis del cloruro de calcio
Las fuentes naturales de este compuesto son las salmueras extraídas de los mares o de los lagos.
Sin embargo, su principal fuente proviene del proceso Solvay, en el cual la piedra caliza (CaCO3) sufre una serie de transformaciones hasta derivar en el subproducto cloruro de calcio:
2NaCl(aq) + CaCO3(s) => Na2CO3(s) + CaCl2(ac)
El producto de interés de este proceso es en realidad el carbonato de sodio, Na2CO3.
Propiedades del cloruro de calcio
Propiedades físicasy delicuescencia
Es un sólido blanco, inodoro e higroscópico. Esta tendencia a absorber humedad del ambiente es debida a la basicidad de los iones Ca2+.
¿Basicidad de qué tipo: de Lewis o Bronsted? De Lewis, por el hecho de que la especie positiva es capaz de aceptar electrones. Estos electrones son donados, por ejemplo, por los átomos de oxígeno de las moléculas de agua.
El sólido absorbe humedad hasta el grado de disolverse en la misma agua que moja sus cristales. Esta propiedad es conocida como delicuescencia.
Su densidad es 2,15 g/mL. A medida que incorpora agua a su estructura, el cristal se “dilata”, aumentando su volumen y, en consecuencia, disminuyendo la densidad. Solo el CaCl2·H2O rompe con esta tendencia, mostrando una densidad mayor (2,24 g/mL).
El peso molecular de la sal anhídrida es aproximadamente 111 g/mol, y por cada molécula de agua en su estructura este peso aumenta 18 unidades.
Solubilidad
El CaCl2 es muy soluble en agua y en algunos solventes polares, tales como etanol, ácido acético, metanol y otros alcoholes.
Calor de disolución
Cuando se disuelve en agua el proceso es exotérmico y, por tanto, calienta la solución y sus alrededores.
Esto es debido a que el complejo acuoso estabiliza en mejor grado los iones Ca2+ en disolución que las interacciones electrostáticas con los iones Cl–. Como el producto es más estable, el sólido libera energía en forma de calor.
Descomposición electrolítica
El CaCl2 fundido puede ser sometido a electrólisis, proceso físico que consiste en la separación de un compuesto en sus elementos a partir de la acción de una corriente eléctrica. En el caso de esta sal, los productos son calcio metálico y cloro gaseoso:
CaCl2(l) → Ca(s) + Cl2(g)
Los iones Ca2+ se reducen en el cátodo, mientras que los iones Cl– son oxidados en el ánodo.
Referencias
- Wikipedia. (2018). Calcium chloride. Recuperado de en.wikipedia.org
- Shiver & Atkins. (2008). Química Inorgánica. En Los elementos del grupo 2. (Cuarta edición., pág. 278). Mc Graw Hill.
- PubChem. (2018). Calcium Chloride. Recuperado de pubchem.ncbi.nlm.nih.gov.
- OxyChem. Calcium Chloride: A Guide to Physical Properties. Recuperado de oxy.com
- Carole Ann. Common Uses of Calcium Chloride. Recuperado de hunker.com
