Cloruro de manganeso: propiedades, estructura, usos, riesgos
El cloruro de manganeso es una sal inorgánica cuya fórmula química es MnCl2. Se compone de iones Mn2+ y Cl– en una relación 1:2; por cada catión Mn2+ hay el doble de aniones Cl–.
Esta sal puede formar varios hidratos: MnCl2·2H2O, (dihidratada), MnCl2·4H2O (tetrahidratada), y MnCl2·6H2O (hexahidratada) La forma más común de la sal es la tetrahidratada.

Las propiedades físicas del cloruro de manganeso como la densidad, punto de fusión y solubilidad en agua, están influenciadas por su grado de hidratación. Por ejemplo, el punto de fusión de la forma anhidra es mucho mayor que el de la forma tetrahidratada.
El color del cloruro de manganeso es rosado pálido (imagen superior). La palidez es característica de las sales de los metales de transición. El cloruro de manganeso es un ácido de Lewis débil.
El mineral conocido como escacquita es la forma natural anhidra del cloruro de manganeso (II); al igual que la kempita.
El cloruro de manganeso (II) es utilizado como un agente de aleación; catalizador en reacciones de cloración, etc.
Índice del artículo
- 1 Propiedades físicas
- 2 Estructura del cloruro de manganeso
- 3 Nomenclatura
- 4 Usos
- 5 Riesgos
- 6 Referencias
– Forma anhidra: cristales cúbicos rosados.
– Forma tetrahidratada: cristales monoclínicos rojizos ligeramente delicuescentes.
– Anhidro: 125,838 g/mol.
– Dihidratado: 161,874 g/mol.
– Tetrahidratado: 197,91 g/mol.
– Anhidro: 654 ºC.
– Dihidratado: 135 ºC.
– Tetrahidratado: 58 ºC.
Forma anhidra: 1.190 ºC.
– Anhidro: 2,977 g/cm3.
– Dihidratado: 2,27 g/cm3.
– Tetrahidratado: 2,01 g/cm3.
Forma anhidra: 63,4 g/100 ml a 0 ºC; 73,9 g/100 ml a 20 ºC; 88,5 g/100 ml a 40 ºC; y 123,8 g/100 ml a 100 ºC.
Soluble en piridina y etanol, insoluble en éter.
A menos que se tomen las precauciones debidas, la deshidratación de las formas hidratadas a la forma anhidra puede producir una deshidratación hidrolítica, con la producción de cloruro de hidrógeno y oxicloruro de manganeso.
Una solución 0,2 M de cloruro de manganeso tetrahidratado en solución acuosa tiene un pH de 5,5.
Es estable, pero sensible a la humedad e incompatible con los ácidos fuertes, metales reactivos y peróxido de hidrógeno.
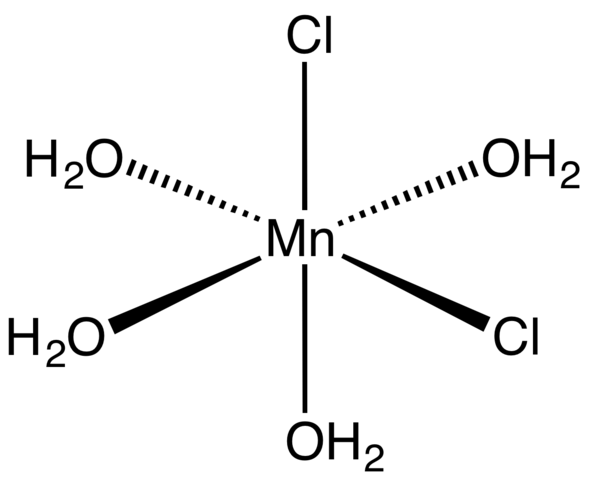
Empezando por la sal tetrahidratada, de cristales rosados y llamativos, se tiene que está compuesta por complejos de coordinación (imagen superior). En ellos, el centro metálico de Mn2+ se ve rodeado de un octaedro definido por cuatro moléculas de H2O y dos aniones Cl–.
Nótese que los ligandos Cl– están en posiciones cis; todas son equivalentes en la base rectangular del octaedro, y no importa si se “mueve” el Cl– a cualquiera de las otras tres posiciones. Otro isómero posible para esta molécula coordinada es en la que ambos Cl– están en posiciones trans; esto es, en diferentes extremos (uno arriba y el otro abajo).
Las cuatro moléculas de agua con sus puentes de hidrógeno permiten que dos o más octaedros se unan mediante fuerzas dipolo-dipolo. Estos puentes son altamente direccionales, y sumando las interacciones electrostáticas entre el Mn2+ y Cl–, establecen una estructura ordenada característica de un cristal.
El color rosado del MnCl2·4H2O se debe a las transiciones electrónicas del Mn2+ y su configuración d5. Asimismo, las perturbaciones ocasionadas por las proximidades de las moléculas de agua y los cloruros modifican la cantidad de energía necesaria que deben absorber tales electrones d5 para transitar niveles energéticos más altos.
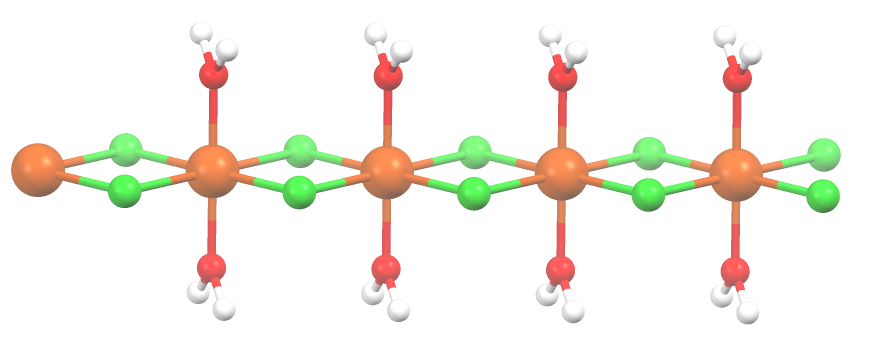
La sal se ha deshidratado y su fórmula pasa a ser ahora MnCl2·2H2O. ¿Qué sucede con el octaedro anterior? Nada, excepto que las dos moléculas de H2O que abandonaron son sustituidas por dos Cl–.
Al principio puede dar la equivocada impresión de que hay cuatro Cl– por cada Mn2+; sin embargo, la mitad del octaedro (axialmente) es en realidad la unidad repetitiva del cristal.
Así, se cumple que hay un Mn2+ coordinado a dos Cl– y dos moléculas de agua en posiciones trans. Pero para que dicha unidad pueda interactuar con otra necesita de dos puentes Cl, lo que a su vez permite que se complete el octaedro de coordinación para el manganeso.
Además de los puentes Cl, las moléculas de agua también colaboran con sus puentes de hidrógeno para que esta cadena MnCl2·2H2O no se desarme.
Finalmente, el cloruro de magnesio ha terminado de perder toda el agua contenida en sus cristales; se tiene ahora la sal anhidra, MnCl2. Sin las moléculas de agua, los cristales pierden notablemente la intensidad de sus coloraciones rosadas. El octaedro, al igual que para los hidratos, permanece inalterado por la propia naturaleza del manganeso.
Sin moléculas de agua, el Mn2+ termina rodeado por un octaedro compuesto solamente de Cl–. Este enlace de coordinación tiene tanto carácter covalente como iónico; por esta razón suele referirse a la estructura del MnCl2 como un cristal polimérico. En él existen capas alternadas de Mn y Cl.
El manganeso tiene muchos estados de oxidación posibles. Debido a eso, la nomenclatura tradicional para el MnCl2 no está esclarecida.
Por otro lado, el cloruro de manganeso corresponde a su nombre más conocido, al cual le faltaría añadir el ‘(II)’ para que esté acuerdo a la nomenclatura stock: cloruro de manganeso (II). Y asçi mismo, está la nomenclatura sistemática: dicloruro de manganeso.
El cloruro de manganeso sirve de catalizador de la cloración de compuestos orgánicos.
El cloruro de manganeso es empleado como materia prima para la elaboración de antidetonantes para la gasolina; material de soldadura para metales no ferrosos; intermediario en la elaboración de pigmentos; y secador del aceite de linaza.
Es utilizado en la industria textil para la impresión y teñido; en la producción de varias sales de manganeso, incluyendo el tricarbonilo de metilciclopentadienilmanganeso usado como colorante de ladrillos; y en la producción de pilas eléctricas secas.
El cloruro de manganeso es usado como agente de aleación y se agrega al magnesio fundido para producir aleaciones manganeso-magnesio; como intermediario en la preparación de agentes de secado para la pintura y el barniz; y como un componente de desinfectantes.
Asimismo, se utiliza en la purificación del magnesio.
El cloruro de manganeso se utiliza como una fuente de manganeso, elemento, que si bien no es un elemento nutricional primario para las plantas como lo son el nitrógeno, el fósforo y el potasio, se emplea en numerosas reacciones bioquímicas propias de estos seres vivos.
Así mismo se agrega al pienso de los animales de cría para el suministro del manganeso, oligoelemento esencial para el crecimiento de los animales.
El cloruro de manganeso es un componente dietético que suministra manganeso, elemento que interviene en numerosos procesos necesarios para la vida, entre ellos: síntesis de ácidos grasos y hormonas sexuales; asimilación de la vitamina E; producción de cartílagos; etc.
Puede producir por contacto con la piel enrojecimiento, irritación y por exposición prolongada dermatitis. El cloruro de manganeso causa en los ojos enrojecimiento, dolor y lagrimeo.
Por inhalación la sal causa tos, dolor de garganta y falta de aliento. Por otro lado, la ingestión podría producirse vómitos, náuseas y diarrea.
La inhalación crónica excesiva de esta sal puede conducir a la inflamación pulmonar y posterior enfermedad reactiva de las vías respiratorias.
Su ingestión excesiva puede causar trastornos mentales, deshidratación, hipotensión, insuficiencia hepática y renal, fallo del sistema multiorgánico y muerte.
La neurotoxicidad es la manifestación inicial de la acción indeseable del manganeso, pudiéndose presentar dolores de cabeza, mareos, pérdida de la memoria, hiperreflexia, y temblor leve.
La toxicidad severa se manifiesta por síntomas y signos semejantes a los observados en la enfermedad de Parkinson.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Manganese(II) chloride. Recuperado de: en.wikipedia.org
- Sky Spring Nanomaterials. (2016). Manganese Chloride Powder. Recuperado de: ssnano.com
- Chemical Book. (2017). Manganese chloride. Recuperado de: chemicalbook.com
- Toxicology Data Network. (s.f.). Manganese chloride. Toxnet. Recuperado de: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Manganese(II) Chloride. doi.org/10.1002/047084289X.rm020
- National Center for Biotechnology Information. (2019). Manganese dichloride. PubChem Database. CID=24480. Recuperado de: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Minerales: manganeso. Recuperado de: webconsultas.com
