Oxalato de amonio: qué es, estructura, propiedades, usos, riesgos

¿Qué es el oxalato de amonio?
El oxalato de amonio es una sal de amonio y ácido oxálico que se combinan en una relación 2:1. Es una sal blanca (incolora), inodora y no volátil.
Se produce a partir de una reacción de neutralización en agua del ácido oxálico, H2C2O4, con el carbonato de amonio o hidróxido de amonio. En el primer caso, se produce CO₂ en forma secundaria.
Su fórmula molecular es C2H8N2O4, pero esta se escribe comúnmente como (NH4)2C2O4. Se produce biológicamente en los animales vertebrados, partiendo del metabolismo del ácido glioxílico o del ácido ascórbico.
El oxalato de amonio puede estar presente en algunos tipos de cálculos renales, aunque la mayor proporción de los cálculos renales de oxalato, este se encuentra combinado con el calcio, formando oxalato de calcio.
No puede metabolizarse en el cuerpo humano, pero puede absorberse en el intestino y ser excretado en las heces. También puede eliminarse del cuerpo humano a través de la orina.
En la naturaleza, se halla en el mineral oxammita, el cual se considera un mineral muy escaso y raro.
Además, se encuentra presente en el guano: un producto de la descomposición de las heces de aves marinas, murciélagos y focas en un ambiente muy árido. El guano, debido a su riqueza en nitrógeno, ha sido usado como fertilizante y fungicida para las plantas.
Estructura química del oxalato de amonio
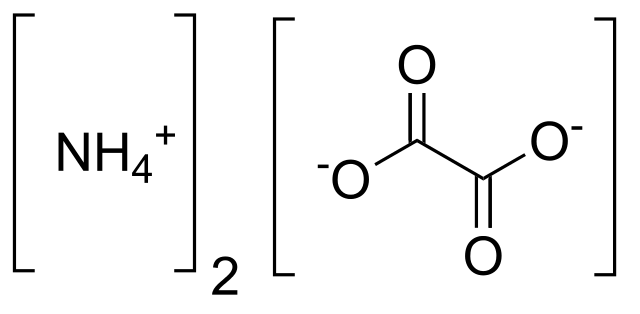
En la imagen superior se muestran las estructuras de los iones que conforman al oxalato de amonio. Aunque no se aprecie, el NH4+ consiste en un tetraedro, mientras que el C2O42- tiene una estructura plana debido a la hibridación sp2 de todos sus átomos de carbono.
Su fórmula química (NH4)2C2O4, indica que debe haber dos NH4+ interaccionando electrostáticamente con un C2O42-. Es decir, dos tetraedros alrededor de un plano.
Además del enlace iónico, los iones son capaces de formar múltiples puentes de hidrógeno. El NH4+ los dona, y el C2O42- los acepta (a través de sus cuatro oxígenos).
Al haber una alta posibilidad de que una molécula también forme puentes de hidrógeno con uno de los iones, esta se intercala dando origen al (NH4)2C2O4∙H2O.
Los cristales se componen de millones de iones y de celdas unitarias, en las cuales se cumple la proporción 2NH4/1C2O4 recién nombrada.
Siendo así, en un cristal de (NH4)2C2O4∙H2O se forma un arreglo cristalino ortorrómbico, donde los puentes de hidrógeno juegan un papel crucial en sus propiedades físicas.
Observando su estructura cristalina desde un plano frontal, los NH4+ forman una fase, mientras que los C2O42- y H₂O forman otra fase: hileras de tetraedros separados por planos y moléculas angulares (el agua).
Propiedades físicas y químicas del oxalato de amonio
Apariencia física
Sólido blanco.
Fórmula molecular
C2H8N2O4
Peso molecular anhidro
124.096 g/mol.
Punto de fusión
70 °C (158 °F), tal como aparece en Wikipedia. Sin embargo, en Chemspider y Softschools señalan un punto de fusión comprendido entre 131 y 135 °C.
Mientras, en Pubchem se señala que la descomposición del compuesto ocurre a 70 °C, haciendo improbable que se pueda hallar un punto de fusión superior a esta temperatura.
Punto de ebullición
Indeterminado por la descomposición del compuesto.
Solubilidad en agua
5.1 g/100 mL de agua a 20 °C. El oxalato de amonio se solubiliza lentamente en el agua y suele hundirse en ella.
Solubilidad en solventes orgánicos
Ligeramente soluble en alcoholes e insoluble en amoníaco.
Densidad
1.5 g/cm3 a 65.3 °F.
Presión de vapor
0 mmHg a 20 °C.
pH
Entre 6 y 7 en una solución al 4% a 25 °C.
Descomposición
Al ser expuesto a altas temperatura, se descompone, emitiendo un humo tóxico y corrosivo que incluye amonio y óxidos de nitrógeno.
Usos del oxalato de amonio
Industriales
– Se utiliza en la manufactura de explosivos.
– Sirve como desestañado electrolítico del hierro.
– Permite pulir la superficie de los metales.
Recientemente, se han extraído pectinas con oxalato de amonio para la fabricación de gelificantes de alimentos.
Reactivo de Wintrobe
Se utiliza en combinación con el oxalato de potasio para formar el reactivo de Wintrobe, el cual se usa como anticoagulante.
El reactivo es una mezcla de 1.2 g de oxalato de amonio con 0.8 g de oxalato de potasio y 0.5 mL de formol, completándose a 100 mL con agua.
Biológicos y analíticos
– La sal de amonio aumenta el volumen de los eritrocitos, mientras la sal de potasio lo disminuye. Por lo tanto, se compensa el efecto de ellas sobre los eritrocitos, garantizándoles la integridad morfológica. Este sistema ejerce su acción anticoagulante mediante el secuestro del ion calcio.
– El oxalato de amonio se utiliza como reactivo analítico y agente reductor, usándose en la cuantificación de la concentración plasmática de calcio y plomo. Además, el oxalato de amonio se usa como un agente dispersante en estudio de las interacciones de la superficie plaquetaria.
– Integra asimismo un sistema amortiguador de pH.
Riesgos en su uso
– El contacto directo con la piel y los ojos puede provocar irritación y quemaduras. Igualmente, el contacto prolongado o repetitivo de la piel con el compuesto, puede causar en ella signos tales como erupciones, resequedad y enrojecimiento.
– Su inhalación puede irritar la nariz, la garganta y los pulmones. La exposición repetida podría causar bronquitis con tos, flema y falta de aire.
– Una alta exposición a esta sal puede causar dolor de cabeza, mareo, náusea, vómito, convulsiones, coma e incluso la muerte.
– La ingestión o inhalación excesiva causa un envenenamiento sistémico. Los síntomas posibles incluyen dolor en la garganta, esófago y estómago. Las membranas de la mucosa se tornan blancas, hay diarreas severas, pulso débil, colapsos cardiovascular y neuromuscular. Además, puede afectar el funcionamiento renal y el balance de calcio.
– El calcio interviene en numerosos procesos que ocurren en los seres vivos, por ejemplo: media la contracción muscular, tanto en la musculatura lisa como la estriada, interviene en las sinapsis de la transmisión neuromuscular, es imprescindible en varias etapas de la cascada de la coagulación, regula la permeabilidad y conductancia iónica en las membranas, etc.
Por lo tanto, al secuestrar el oxalato de amonio al ion calcio se compromete la realización de las funciones imprescindibles para la vida.
Referencias
- Growth and characterization of ammonium oxalate monohydrate single crystals [PDF]. Recuperado de shodhganga.inflibnet.ac.in
- Ammonium Oxalate. Recuperado de pubchem.ncbi.nlm.nih.gov.
