Ácido glutámico: características, funciones, biosíntesis
El ácido glutámico es uno de los 22 aminoácidos que componen a las proteínas de todos los seres vivos y uno de los más abundantes en la naturaleza. Puesto que el cuerpo humano tiene vías intrínsecas para su biosíntesis, este no es considerado como esencial.
Junto con el ácido aspártico, el ácido glutámico pertenece al grupo de los aminoácidos polares cargados negativamente y, de acuerdo con los dos sistemas de nomenclatura existentes (de tres o una letra), se denota como “Glu” o como “E”.
Este aminoácido fue descubierto en 1866 por el químico alemán Rittershausen mientras estudiaba hidrolizados de gluten de trigo, de allí su denominación “glutámico”. Tras su descubrimiento, se ha determinado su presencia en gran parte de los seres vivos, por lo que se piensa que tiene funciones esenciales para la vida.
El ácido L-glutámico se considera como uno de los más importantes mediadores en la transmisión de señales excitatorias en el sistema nervioso central de los animales vertebrados y también es necesario para el funcionamiento normal del cerebro, así como para el desarrollo cognitivo, la memoria y el aprendizaje.
Algunos de sus derivados, además, tienen importantes funciones a nivel industrial, especialmente en lo que respecta a preparaciones culinarias, pues ayuda a potenciar el sabor de las comidas.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Metabolismo y degradación
- 6 Alimentos ricos en ácido glutámico
- 7 Beneficios de su ingesta
- 8 Trastornos por deficiencia
- 9 Referencias
A pesar de no ser un aminoácido esencial para los humanos, el glutamato (la forma ionizada del ácido glutámico) tiene importantes implicaciones nutricionales para el crecimiento animal y se ha planteado que posee un valor nutritivo mucho mayor que el de otros aminoácidos no esenciales.
Este aminoácido es especialmente abundante en el cerebro, sobre todo en el espacio intracelular (citosol), lo que permite la existencia de un gradiente entre el citosol y el espacio extracelular, que es delimitado por la membrana plasmática de las células nerviosas.
Debido a que tiene muchas funciones en las sinapsis excitatorias y a que ejerce sus funciones actuando sobre receptores específicos, su concentración se mantiene en niveles controlados, especialmente en el ambiente extracelular, ya que dichos receptores generalmente “miran” hacia afuera de las células.
Los sitios de mayor concentración de glutamato son los terminales nerviosos, no obstante, su distribución está condicionada por las necesidades energéticas de las células de todo el cuerpo.
Dependiendo del tipo de célula, cuando el ácido glutámico entra a la misma puede ser dirigido hacia la mitocondria, con fines energéticos, o puede redistribuirse hacia vesículas sinápticas y ambos procesos emplean sistemas específicos de transporte intracelular.
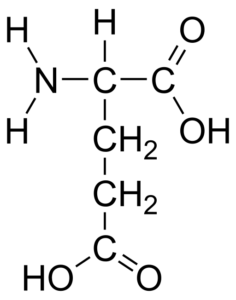
El ácido glutámico, como el resto de los aminoácidos, es un α-aminoácido que posee un átomo de carbono central (que es quiral), el carbono α, al que se unen otros cuatro grupos: un grupo carboxilo, un grupo amino, un átomo de hidrógeno y un grupo sustituyente (cadena lateral o grupo R).
El grupo R del ácido glutámico le otorga a la molécula un segundo grupo carboxilo (-COOH) y su estructura es -CH2-CH2-COOH (-CH2-CH2-COO- en su forma ionizada), por lo que la suma de átomos de carbono totales de la molécula es de cinco.
Este aminoácido tiene una masa relativa de 147 g/mol y la constante de disociación (pKa) de su grupo R es de 4.25. Tiene un punto isoeléctrico de 3.22 y el índice de presencia promedio en proteínas está alrededor del 7%.
Puesto que a pH neutro (alrededor de 7), el ácido glutámico está ionizado y posee carga negativa, es clasificado dentro del grupo de los aminoácidos polares cargados negativamente, grupo en el cual también está incluido el ácido aspártico (aspartato, en su forma ionizada).
El ácido glutámico o su forma ionizada, el glutamato, tiene múltiples funciones, no sólo desde el punto de vista fisiológico, sino también desde el punto de vista industrial, clínico y gastronómico.
Una de las funciones fisiológicas más populares del ácido glutámico en el cuerpo de la mayor parte de los vertebrados es su participación como neurotransmisor excitador en el cerebro. Se ha determinado que más del 80% de las sinapsis excitatorias se comunican empleando glutamato o alguno de sus derivados.
Entre las funciones que tienen las sinapsis que emplean este aminoácido durante la señalización están el reconocimiento, el aprendizaje, la memoria y otras.
El glutamato también está relacionado con el desarrollo del sistema nervioso, con la iniciación y la eliminación de la sinapsis y con la migración, la diferenciación y la muerte celular. Es importante para la comunicación entre órganos periféricos como el tracto alimentario, el páncreas y los huesos.
Adicionalmente, el glutamato tiene funciones tanto en los procesos de síntesis proteica y peptídica, como en la síntesis de ácidos grasos, en la regulación de los niveles celulares de nitrógeno y en el control del balance aniónico y osmótico.
Sirve como precursor para diferentes intermediarios del ciclo de ácidos tricarboxílicos (ciclo de Krebs) y también de otros neurotransmisores como el GABA (ácido gamma aminobutírico). A su vez, es precursor en la síntesis de otros aminoácidos como la L-prolina, la L-arginina y la L-alanina.
Diferentes enfoques farmacéuticos se basan principalmente en los receptores de ácido glutámico como blancos terapéuticos para el tratamiento de enfermedades psiquiátricas y otras patologías relacionadas con la memoria.
El glutamato también ha sido empleado como agente activo en diferentes formulaciones farmacológicas diseñadas para tratar infartos al miocardio y dispepsia funcional (problemas gástricos o indigestiones).
El ácido glutámico y sus derivados tienen diversas aplicaciones en distintas industrias. Por ejemplo, la sal monosódica de glutamato es empleada en la industria alimenticia como condimento.
Este aminoácido también es el material de partida para la síntesis de otros químicos y el poliácido glutámico es un polímero aniónico natural biodegradable, comestible y no tóxico para los humanos o para el medio ambiente.
En la industria alimenticia es empleado también como espesante y como agente “aliviador” del amargor de diferentes alimentos.
También es empleado como crioprotector, como adhesivo biológico “curable”, como transportador de drogas, para el diseño de fibras biodegradables y de hidrogeles capaces de absorber grandes cantidades de agua, entre otros.
Todos los aminoácidos derivan de intermediarios glucolíticos, del ciclo de Krebs o de la ruta de las pentosas fosfato. El glutamato, específicamente, es obtenido a partir de la glutamina, del α-cetoglutarato y de la 5-oxoprolina, todos derivados del ciclo de Krebs.
La ruta biosintética de este aminoácido es bastante simple y sus pasos están en casi todos los organismos vivos.
En el metabolismo del nitrógeno, es a través del glutamato y la glutamina que el amonio es incorporado a las diferentes biomoléculas del cuerpo y, por medio de reacciones de transaminación, el glutamato proporciona los grupos amino de la mayoría de los aminoácidos.
Así, dicha ruta implica la asimilación de los iones amonio a moléculas de glutamato, lo que tiene lugar en dos reacciones.
El primer paso de la ruta es catalizado por una enzima conocida como glutamina sintetasa, que está presente en prácticamente todos los organismos y que participa en la reducción de glutamato y amonio para producir glutamina.
En las bacterias y las plantas, en cambio, el glutamato es producido a partir de la glutamina por la enzima conocida como glutamato sintasa.
En los animales, este es producido a partir de la transaminación del α-cetoglutarato, que tiene lugar durante el catabolismo de aminoácidos. Su función principal en los mamíferos es la de convertir el amonio libre tóxico en glutamina, que es transportada por la sangre.
En la reacción catalizada por la enzima glutamato sintasa, el α-cetoglutarato pasa por un proceso de aminación reductiva, donde la glutamina participa como donante del grupo nitrogenado.
Aunque ocurre en mucha menor proporción, en los animales el glutamato también es producido por la reacción de un solo paso entre el α-cetoglutarato y el amonio (NH4), que es catalizada por la enzima L-glutamato deshidrogenasa, ubicua virtualmente en todos los organismos vivos.
Dicha enzima se asocia con la matriz mitocondrial y la reacción que cataliza puede escribirse más o menos como sigue, donde el NADPH funciona en el suministro de poder reductor:
α-cetoglutarato + NH4 + NADPH → L-glutamato + NADP(+) + agua
El ácido glutámico es empleado por las células del cuerpo para servir diferentes propósitos, entre los que resaltan la síntesis de proteínas, el metabolismo energético, la fijación de amonio o la neurotransmisión.
El glutamato tomado del medio extracelular en algunos tipos de células nerviosas puede ser “reciclado” al ser convertirlo en glutamina, que es liberada a los fluidos extracelulares y tomada por las neuronas para ser transformada nuevamente en glutamato, lo que se conoce como el ciclo glutamina-glutamato.
Una vez ingerido con los alimentos de la dieta, la absorción intestinal del ácido glutámico termina, generalmente, en su transformación en otros aminoácidos como la alanina, proceso mediado por las células de la mucosa intestinal, quienes también lo emplean como fuente de energía.
El hígado, por otra parte, se encarga de convertirlo en glucosa y lactato, de los que se extrae energía química principalmente en forma de ATP.
Se ha reportado la existencia de diversas enzimas metabolizadoras de glutamato en distintos organismos, tal es el caso de las glutamato deshidrogenasas, de las glutamato-amonio liasas y de las glutaminasas y muchas de estas han sido implicadas con la enfermedad de Alzheimer.
El ácido glutámico está presente en la mayor parte de los alimentos consumidos por el hombre y algunos autores afirman que para un ser humano de 70 kg de peso, la ingesta diaria de ácido glutámico derivada de la dieta está alrededor de los 28 g.
Entre los alimentos más ricos en este aminoácido se encuentran los de origen animal, donde resaltan los cárnicos (bovino, porcino, ovino, etc.), huevos, lácteos y pescados. Los alimentos de origen vegetal ricos en glutamato son las semillas, los granos, los espárragos y otros.
Además de los distintos tipos de alimentos naturalmente ricos en este aminoácido, un derivado del mismo, la sal monosódica del glutamato es empleado como aditivo para potenciar o incrementar el sabor de numerosos platillos y alimentos procesados industrialmente.
El glutamato añadido a diferentes preparaciones culinarias ayuda a “inducir” el sabor y a mejorar la sensación del gusto en la cavidad bucal, lo que aparentemente tiene importantes significados fisiológicos y nutricionales.
Ensayos clínicos han demostrado que la ingesta de ácido glutámico tiene aplicaciones potenciales en el tratamiento de “desórdenes” o patologías bucales relacionadas con el gusto y la “hiposalivación” (escasa producción de saliva).
Así mismo, el ácido glutámico (glutamato) es un nutriente de gran importancia para el mantenimiento de la actividad normal de las células en la mucosa intestinal.
Se ha demostrado que el suministro de este aminoácido a ratas que han sido sometidas a tratamientos quimioterapéuticos incrementa las características inmunológicas del intestino, además de mantener y potenciar la actividad y las funciones de la mucosa intestinal.
En Japón, por otra parte, se han diseñado dietas médicas basadas en alimentos ricos en ácido glutámico para pacientes sometidos a “gastronomía endoscópica percutánea”, es decir, que deben ser alimentados a través de un tubo estomacal que se conecta a través de la pared abdominal.
Este aminoácido también es empleado para inducir el apetito en pacientes ancianos con gastritis crónica que son normalmente inapetentes.
Por último, estudios relacionados con el suministro oral de ácido glutámico y arginina sugieren que estos están implicados en la regulación positiva de los genes relacionados con la adipogénesis en el tejido muscular y con la lipólisis en los tejidos adiposos.
Puesto que el ácido glutámico sirve como precursor en la síntesis de diversos tipos de moléculas como aminoácidos y otros neurotransmisores, defectos genéticos asociados con la expresión de las enzimas relacionadas con su biosíntesis y reciclaje pueden tener consecuencias para la salud del cuerpo de cualquier animal.
Por ejemplo, la enzima ácido glutámico descarboxilasa es la encargada de la conversión del glutamato en ácido gamma aminobutírico (GABA) un neurotransmisor esencial para las reacciones nerviosas inhibitorias.
Por lo tanto, el balance entre el ácido glutámico y el GABA es de suma importancia para el mantenimiento del control de la excitabilidad cortical, ya que el glutamato funciona principalmente en las sinapsis nerviosas excitatorias.
A su vez, dado que el glutamato está implicado en una serie de funciones cerebrales como el aprendizaje y la memoria, su deficiencia podría causar defectos en estas clases de procesos cognitivos que lo requieren como neurotransmisor.
- Ariyoshi, M., Katane, M., Hamase, K., Miyoshi, Y., Nakane, M., Hoshino, A., … Matoba, S. (2017). D -Glutamate is metabolized in the heart mitochondria. Scientific Reports, 7(August 2016), 1–9. https://doi.org/10.1038/srep43911
- Barret, G. (1985). Chemistry and Biochemistry of the Amino Acids. New York: Chapman and Hall.
- Danbolt, N. C. (2001). Glutamate uptake. Progress in Neurobiology, 65, 1–105.
- Fonnum, F. (1984). Glutamate: a neurotransmitter in the mammalian brain. Journal of Neurochemistry, 18(1), 27–33.
- Garattini, S. (2000). International Symposium on Glutamate. Glutamic Acid, Twenty Years Later.
- Graham, T. E., Sgro, V., Friars, D., & Gibala, M. J. (2000). Glutamate ingestion: The plasma and muscle free amino acid pools of resting humans. American Journal of Physiology- Endocrinology and Metabolism, 278, 83–89.
- Hu, C. J., Jiang, Q. Y., Zhang, T., Yin, Y. L., Li, F. N., Su, J. Y., … Kong, X. F. (2017). Dietary supplementation with arginine and glutamic acid enhances key lipogenic gene expression in growing pigs. Journal of Animal Science, 95(12), 5507–5515.
- Johnson, J. L. (1972). Glutamic Acid as a Synaptic Transmitter in the Nervous System. A review. Brain Research, 37, 1–19.
- Kumar, R., Vikramachakravarthi, D., & Pal, P. (2014). Production and purification of glutamic acid: A critical review towards process intensification. Chemical Engineering and Processing: Process Intensification, 81, 59–71.
- Mourtzakis, M., & Graham, T. E. (2002). Glutamate ingestion and its effects at rest and during exercise in humans. Journal of Applied Physiology, 93(4), 1251–1259.
- Neil, E. (2010). Biological Processes for Hydrogen Production. Advances in Biochemical Engineering/Biotechnology, 123(July 2015), 127–141. https://doi.org/10.1007/10
- Okumoto, S., Funck, D., Trovato, M., & Forlani, G. (2016). Amino acids of the glutamate family: Functions beyond primary metabolism. Frontiers in Plant Science, 7, 1–3.
- Olubodun, J. O., Zulkifli, I., Farjam, A. S., Hair-Bejo, M., & Kasim, A. (2015). Glutamine and glutamic acid supplementation enhances performance of broiler chickens under the hot and humid tropical condition. Italian Journal of Animal Science, 14(1), 25–29.
- Umbarger, H. (1978). Amino Acid Biosynthesis and its Regulation. Ann. Rev. Biochem., 47, 533–606.
- Waelsch, H. (1951). Glutamic Acid and Cerebral Function. Advances in Protein Chemistry, 6, 299–341.
- Yelamanchi, S. D., Jayaram, S., Thomas, J. K., Gundimeda, S., Khan, A. A., Singhal, A., … Gowda, H. (2015). A pathway map of glutamate metabolism. Journal of Cell Communication and Signaling, 10(1), 69–75.
