Hidruro de calcio ( CaH2): propiedades, reactividad y usos
El hidruro de calcio es un compuesto químico de fórmula CaH2, lo cual lo hace un hidruro alcalino terreo. Este compuesto químico posee dos enlaces iónicos entre el calcio y los dos iones hidruros, como se muestra en la figura 1.
Se trata de un hidruro salino, lo que quiere decir que su estructura es parecida a la sal. Su estructura cristalina es la misma que la del cloruro de plomo (mineral cotunnita) como muestra la figura 2.
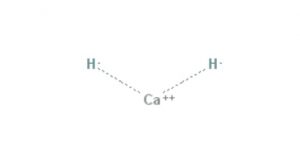
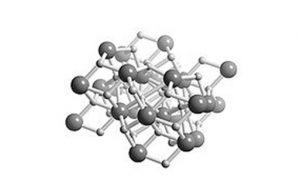
Todos los metales alcalinos y alcalino-térreos forman sales de hidruro. En la química, un hidruro es el anión del hidrógeno, H- o, más comúnmente, es un compuesto en el cual uno o más centros de hidrógeno tienen propiedades nucleofílicas, reductoras o básicas.
En los compuestos que se consideran hidruros, el átomo de hidrógeno está unido a un elemento o grupo más electropositivo.
Se puede producir haciendo reaccionar calcio e hidrógeno a una temperatura entre 300 o 400 grados centígrados. Otra forma de preparar el hidruro de calcio es calentar el cloruro de calcio junto con hidrógeno y sodio metálico. La reacción sucede de la siguiente manera:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
En esta reacción el calcio (Ca) y el hidrógeno (H) crean una molécula del hidruro de calcio mientras que los átomos de sodio junto con el cloro crean moléculas del cloruro de sodio (NaCl).
El hidruro de calcio también puede producirse reduciendo el óxido de calcio (CaO) con magnesio (Mg). La reacción se realiza en presencia de hidrógeno. Esta reacción también produce óxido de magnesio (MgO). A continuación se presenta la fórmula para esta reacción química:
CaO + Mg + H2 → CaH2 + MgO
Índice del artículo
- 1 Propiedades físicas y químicas del hidruro de calcio
- 2 Reactividad y peligros
- 3 Manejo y almacenaje
- 4 Usos y aplicaciones
- 5 Desventaja en el uso del hidruro de calcio
- 6 Referencias
El hidruro de calcio es un conjunto de cristales de estructura ortorrómbica de color blanco cuando está puro. Generalmente, es raro encontrarlo en esta forma por lo que suele tener una tonalidad grisácea. Carece de un olor característico. Su apariencia se muestra en la figura 3 (Royal Society of Chemistry , 2015).
Posee un peso molecular de 42.094 g/mol, tiene un punto de fusión de 816 grados centígrados y una densidad de 1.70 g/ml. Si se disuelve en agua reacciona violentamente produciendo hidrógeno. También reacciona con alcohol (National Center for Biotechnology Information., S.F.).
El hidruro de calcio es un producto químico estable, aunque es altamente reactivo al agua o la humedad. En contacto con el agua, libera gases inflamables de hidrógeno que pueden encenderse espontáneamente.
Se considera un compuesto explosivo. Cuando se calienta en una reacción con tetrahidrofurano, puede causar una explosión. Cuando se mezcla con clorato, hipoclorito, bromato, perclorato de potasio, se hace sensible al calor, a la fricción y se hace explosivo (Calcium Hydride 7789-78-8, 2016).
Cuando el fluoruro de plata es triturado con hidruro de calcio, la masa se vuelve incandescente. El calentamiento fuerte del hidruro con cloro, bromo o yodo conduce a la incandescencia.
Mezclas del hidruro con diversos bromatos, por ejemplo el bromato de bario o cloratos, por ejemplo el clorato de bario y percloratos como perclorato de potasio, explotan al triturar. CaH2 reacciona incandescentemente con fluoruro de plata si está sujeto a fricción.
Este compuesto debe manejarse bajo una atmósfera inerte. Si no se maneja adecuadamente, puede representar una seria amenaza para la salud y seguridad del personal de laboratorio, de los socorristas y de los manipuladores de desechos químicos (UC center for laboratory safety, 2013).
Extremadamente peligroso en caso de contacto con la piel o los ojos, ya que es irritante. Muy peligroso en caso de contacto con la piel pues puede ser corrosivo.
También es peligroso en caso de ingestión e inhalación. La cantidad de daño tisular depende de la longitud del contacto. El contacto con los ojos puede resultar en daño corneal o ceguera.
El contacto con la piel puede producir inflamación y ampollas. La inhalación de polvo producirá irritación de las vías gastrointestinales o respiratorias, caracterizada por ardor, estornudos y tos.
La sobreexposición severa puede producir daño pulmonar, asfixia, inconsciencia y hasta la muerte. La inflamación del ojo se caracteriza por enrojecimiento, riego y picazón. La inflamación de la piel se caracteriza por picazón, descamación, enrojecimiento o, ocasionalmente, formación de ampollas.
La exposición repetida de los ojos a un nivel bajo puede producir irritación en los ojos. La exposición repetida a la piel puede producir destrucción local de la piel, o dermatitis.
La inhalación repetida de polvo puede producir un grado variable de irritación respiratoria o daño pulmonar. La inhalación repetida o prolongada de polvo puede provocar irritación respiratoria crónica (Material Safety Data Sheet Calcium hydride MSDS, 2005).
En caso de contacto con los ojos, se deben enjuagar inmediatamente con abundante agua durante al menos 15 minutos, levantando ocasionalmente los párpados superior e inferior.
En caso de contacto con la piel se debe enjuagar inmediatamente con abundante agua durante al menos 15 minutos mientras se quita la ropa contaminada y los zapatos.
En caso de ingesta no se debe inducir vómito. Se debe llamar a un centro de control de envenenamiento. Es recomendable retirarse del lugar de exposición y trasladarse al aire libre inmediatamente.
En caso de inhalación, si respirar resulta difícil es necesario suministrar oxígeno. No se debe dar respiración boca a boca si la victima ingirió o inhaló la sustancia.
Se debe inducir la respiración artificial con la ayuda de una máscara de bolsillo equipada con una válvula unidireccional u otro dispositivo médico respiratorio adecuado. En todos los casos se debe obtener atención médica inmediatamente.
El compuesto se debe mantener en un recipiente seco lejos del calor. Se debe mantener alejado de fuentes de ignición. No se debe respirar el polvo. No se debe añadir agua a este producto
En caso de ventilación insuficiente, use equipo respiratorio adecuado como una máscara con filtro. En caso de exposición, se debe buscar atención médica y mostrar la etiqueta en la medida de lo posible. Evitar el contacto con la piel y los ojos.
Los materiales inflamables, en general, deben ser almacenados en un armario o cuarto de almacenamiento de seguridad separado. Mantener el envase herméticamente cerrado.
Mantener en un lugar fresco y bien ventilado. Se deben conectar a tierra todos los equipos que contengan material para evitar chispas eléctricas. El recipiente debe mantenerse seco y en un lugar fresco.
Es un material no inflamable. Sin embargo, los bomberos deben usar equipo apropiado mientras se extingue un incendio alrededor de este compuesto químico.
Nunca es aconsejable utilizar agua para extinguir un incendio alrededor del hidruro de calcio. Se puede utilizar arena seca, así como compuestos como cloruro de sodio y carbonato sódico para este fin.
Para eliminar desechos de hidruro de calcio, se debe descomponer al agregar 25 ml de metanol por cada gramo de hidruro bajo una atmosfera de nitrógeno mientras se agita.
Una vez acabada la reacción, se añade el mismo volumen de agua al compuesto acuoso de metóxido de calcio y se desecha en el drenaje con abundante agua (national research council, 1995).
El hidruro de potasio es un desecante relativamente suave. Debido a esta razón, el uso de este compuesto como un desecante es más seguro en comparación con agentes más reactivos, como las aleaciones de sodio-potasio y sodio metal. Reacciona con el agua de la siguiente manera:
CaH2 + 2 H2O → Ca(OH)2 + 2 H2
Los productos de hidrólisis de esta reacción, hidrógeno (gas) y Ca (OH) 2 (una mezcla acuosa), pueden separarse del disolvente químico siguiendo un proceso de filtración, destilación o decantación.
Este compuesto químico es un desecante eficaz para muchos disolventes básicos como aminas y piridina. A veces se usa para pre-secar disolventes antes de usar desecantes más reactivos.
En la década de 1940, este compuesto estaba disponible como una fuente de hidrógeno bajo el nombre comercial de “Hydrolith”.
Se ha utilizado como fuente de hidrógeno durante mucho tiempo. Todavía se utiliza para producir hidrógeno puro en laboratorios para diversos experimentos, pilas de combustible avanzadas y aplicaciones de baterías (American Elements, S.F.).
El compuesto ha sido ampliamente utilizado durante décadas como un medio seguro y conveniente para inflar globos meteorológicos.
Asimismo, se utiliza regularmente en laboratorios para producir pequeñas cantidades de hidrógeno altamente puro para experimentos. El contenido de humedad del combustible diésel se calcula por el hidrógeno desarrollado tras el tratamiento con CaH2.
Cuando se calienta entre 600 y 1000 grados centígrados, el óxido de zirconio, niobio, uranio, cromo, titanio, vanadio y tántalo se puede reducir para preparar el polvo de estos metales, por lo que el hidruro de calcio se puede utilizar en la metalurgia de polvo.
La siguiente reacción ilustra la manera en que el hidruro de calcio actúa como agente reductor:
TiO + 2CaH2 → CaO + H2 + Ti
Este compuesto químico es, a menudo, la elección preferida como agente de secado; Sin embargo, también tiene algunas desventajas:
-La acción de secado de este compuesto es lenta, ya que no es soluble en ningún disolvente con el que no reaccione violentamente.
-Este compuesto en polvo es incompatible con muchos disolventes. Su reacción con los clorocarbonos puede incluso provocar explosiones.
-No se puede utilizar para disolventes desoxigenantes, ya que no es capaz de eliminar el oxígeno disuelto.
-Diferenciar entre hidruro de calcio e hidróxido de calcio es bastante difícil debido a sus apariencias similares.
- American Elements. (S.F.). calcium hydride. Retrieved from americanelements.com: americanelements.com.
- Calcium Hydride 7789-78-8. (2016). Retrieved from chemicalbook.com: chemicalbook.com.
- calcium hydride. (s.f.). Retrieved from chemistry learner: chemistrylearner.com.
- Material Safety Data Sheet Calcium hydride MSDS. (2005, octubre 10). Retrieved from sciencelab.com: sciencelab.com.
- National Center for Biotechnology Information. (S.F.). PubChem Compound Database; CID=105052. Retrieved from pubchem.ncbi.nlm.nih.gov: pubchem.ncbi.nlm.nih.gov.
- national research council. (1995). Prudent Practices in the Laboratory: Handling and Disposal of Chemicals. Washinton: NationalAacademy Press.
- Royal Society of Chemistry . (2015). calcium hydride ID 94784. Retrieved from chemspider.com: chemspider.com.
- UC center for laboratory safety. (2013, enero 18). standar operatin procedure calcium hydride. Retrieved from chemengr.ucsb.edu: chemengr.ucsb.edu.
