Fenómenos químicos: características y ejemplos
Los fenómenos químicos son todos aquellos que comprenden una serie de reacciones químicas y que se presentan en la vida diaria. Si bien es cierto que las reacciones químicas pueden estudiarse o realizarse dentro de un laboratorio, los fenómenos químicos se aprecian en cualquier lugar; al aire libre, en las nubes, en nuestros organismos o en la misma cocina.
Algunos ejemplos de cambios químicos son quemar madera, digerir comida, cocinar un huevo, la oxidación del hierro, hornear un pastel, la pudrición de una fruta, asar carne, la explosión de fuegos artificiales, entre otros.

Es fácil reconocer los fenómenos químicos, aunque no se hallan aislados sino en conjunto con cambios físicos (o biológicos). Se dice que ha ocurrido un fenómeno químico cuando se observa un incremento de la temperatura, liberación de gases, iluminación repentina, formación de precipitados; o cambios de olor, color o textura.
No obstante, todos los fenómenos químicos comparten en común la transformación en la identidad de la materia; el rompimiento de enlaces para establecerse otros nuevos, la desaparición de reactivos para generarse productos.
Un “simple” fenómeno químico puede englobar o encasillar un número vasto de reacciones químicas que obedezcan uno o más mecanismos. Esto ocurre particularmente cuando cocinamos, horneamos (galletas de la imagen superior) o comemos, así como en procesos bioquímicos interesantes como la bioluminiscencia.
Índice del artículo
Cada reacción química por separado posee un conjunto de características que permite reconocerlas o clasificarlas del resto; sean estas de doble desplazamiento (metátesis), precipitación, neutralización, adición, isomerización, óxido-reducción, hidrogenación, combustión, pirolisis, saponificación, polimerización y muchas otras más.
Algunas de ellas pueden ser reversibles (los productos vuelven a formar los reactivos) o irreversibles (solo hay formación de productos). Asimismo, algunas son exotérmicas, endotérmicas, lentas o rápidas (con o sin catalizador).
Todas sin embargo concuerdan en un cambio en la identidad de la materia (átomo, grupo funcional, molécula, etc.). Esto ocasiona una variación en una de las propiedades del sistema, las cuales vienen a ser: color, olor, pH, temperatura, presión, viscosidad, masa, volumen, densidad, índice de refracción, entre otros.
Asimismo es frecuente observar burbujeo, aparición de precipitado o de doble fases, destellos, o explosiones. Un fenómeno químico se caracteriza entonces por mostrar una combinación de tales cambios, y puede además consistir de una serie de reacciones o transformaciones vinculadas estrechamente entre sí.
Es por eso que, dependiendo del prisma con que se visualice, los fenómenos químicos aluden principalmente a todos los procesos naturales o cotidianos donde se perciba que hubo una o más reacciones químicas simultáneas.

Si bien no todos los mecanismos de cristalización de minerales son estrictamente fenómenos químicos, sí lo es cuando proceden a partir de una disolución acuosa, la cual lentamente se va evaporando mientras los iones se agrupan y forman cristales salinos.
Las corrientes de agua pueden arrastrar los iones de las rocas a otras regiones, donde finalmente se evapora y dejan un rastro de cristales; tal como sucede, por ejemplo, en los lagos de sales.

Donde hay fuego hay una oxidación vigorosa y altamente exotérmica. Al encender la cabeza de una cerilla esta se quema con el oxígeno del aire para producir óxidos, lo cual no solo se evidencia por el calor, sino también por el cambio de color en la cerilla de rojo a negro.
Un incendio es, pues, un fenómeno químico que implica la formación de muchos óxidos; aunque si ocurre en un bosque, selva o montaña, estos constarán casi en su totalidad de monóxido de carbono, así como óxidos de nitrógeno y azufre.

La lluvia ácida es un fenómeno químico que involucra la hidratación de varios óxidos ácidos gaseosos (NOx, SO3, ClO2, CO2). Estos óxidos gaseosos al interaccionar con las gotas de agua de las nubes se transforman en sus respectivos oxoácidos (HNO3, H2SO4, HClO3, H2CO3), los cuales terminan siendo descargados en la lluvia.
Las lluvias ácidas se caracterizan por su alto contenido de HNO3 y H2SO4, afectando los ecosistemas acuáticos, los sembradíos, acidifican el agua de los ríos y deterioran las estatuas de mármol.
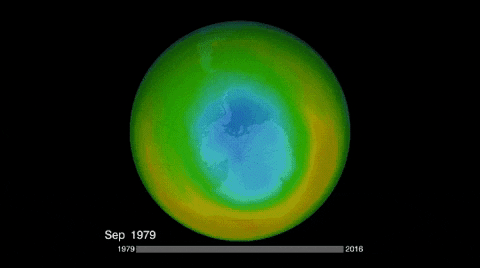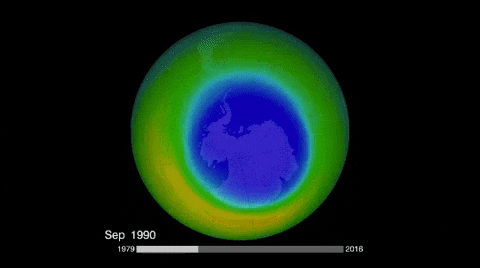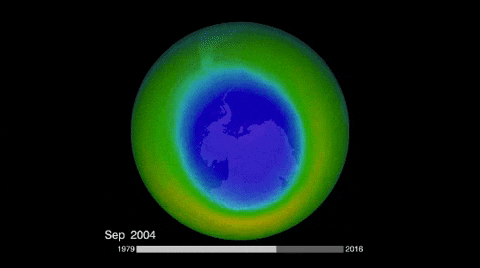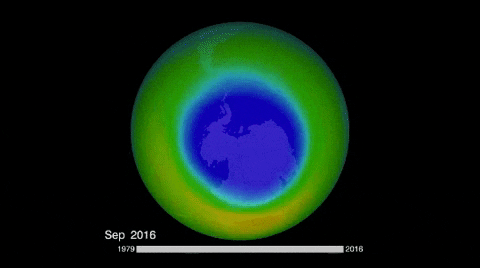
El ozono de la estratósfera se produce cuando el oxígeno reacciona con la radiación ultravioleta del sol; y su destrucción natural, aunque por mecanismo distinto, vuelve a regenerar el oxígeno.
Sin embargo, hay especies químicas que a causa de la radiación ultravioleta se descomponen en radicales libres que destruyen al ozono, inhibiéndolo de su acción protectora.
La fermentación es un ejemplo de fenómeno químico porque los microorganismos catalizan reacciones sobre un sustrato orgánico, que por lo general se trata de un alimento, jugo o bebida, para generar un cambio drástico en sus propiedades organolépticas; en especial a lo que respecta a su sabor, como ocurre con la cerveza y el vino.
Pudiera escribirse un libro versado en todos los fenómenos químicos que toman lugar mientras cocinamos. Para empezar, el uso del fuego ya implica la desnaturalización de las proteínas que integran los alimentos, su deshidratación, y el rompimiento de ciertos enlaces para generar productos que intensifican sus sabores y colores.
Hervir un huevo, hornear panes o galletas, freír pollo o bistecs, preparar café, calentar pasta, aderezar una ensalada con vinagre, fermentar piñas, añadirle limón al pescado para neutralizar sus aminas volátiles, etc., son ejemplos en esencia de fenómenos químicos.

Otro fenómeno químico particular que ocurre frecuentemente dentro de la cocina es la caramelización. Esta consiste en quemar parcialmente una disolución azucarada hasta que se torne dorada o de color marrón; es decir, se detiene justo en el momento en el que esté listo el caramelo.
Los azúcares comienzan a deshidratarse por acción del calor para originar un compendio de moléculas; algunas pequeñas (furanona y maltol), gracias a las cuales el caramelo posee su olor característico; otras poliméricas (caramelina y caramelano), responsables de los colores del caramelo.
Cuando los azúcares están acompañados además de proteínas ocurre la reacción de Maillard, donde ahora los azúcares reaccionan con los grupos aminos de estas.
Nuevamente, es típico observar el fenómeno químico que involucra tal reacción en el horneado de galletas o bizcochos, en la preparación de cervezas, en la fritura de tocinos, en el dorado de las carnes, en el asado del pollo, en el tostado de los cereales, etc.

Finalmente, y no menos importante o curioso, tenemos la bioluminiscencia, donde organismos o criaturas son capaces de generar, mediante la acción de la enzima luciferasa sobre la proteína luciferina, su propia luz. Un claro ejemplo se aprecia en las luciérnagas y sus parpadeos amarillos a través de la noche.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Elsevier. (2019). Chemical Phenomena. Recuperado de: sciencedirect.com
- Helmenstine, Anne Marie, Ph.D. (16 de octubre de 2019). Examples of Chemical Reactions in Everyday Life. Recuperado de: thoughtco.com
- Wikipedia. (2019). Chemical reaction. Recuperado de: en.wikipedia.org
- Rice University. (2019). Classifying Chemical Reactions. Recuperado de: openstax.org
- The Biomimicry Institute. (27 de enero de 2017). Chemistry of Nature. Recuperado de: asknature.org
- Ashley Hamer. (14 de mayo de 2018). 10 Ways to Hack Your Cooking with Chemistry. Recuperado de: curiosity.com
- Compound Interest. (2018). Food Chemistry – The Maillard Reaction. Recuperado de: compoundchem.com
- Ashish. (25 de marzo de 2018). Why Does Sugar Turn Brown When Melted? Recuperado de: scienceabc.com
