Berilio: historia, estructura, propiedades, usos
El berilio es un elemento metálico que pertenece al grupo 2 o IIA de la tabla periódica. Es el metal alcalinotérreo más liviano del grupo, y se representa mediante el símbolo Be. Su átomo y catión son además más pequeños que los de sus congéneres (Mg, Ca, Sr…).
Debido a su inusual densidad de carga, este metal no suele presentarse en forma aislada. Se conocen cerca de 30 minerales que lo contienen, entre los cuales están: el berilo (3BeO·Al2O3·6SiO2·2H2O), la bertrandita (4BeO.2SiO2.2H2O), el crisoberilo (BeAl2O4), y la fenaquita (Be2Si4).

La esmeralda, una piedra preciosa, es una variante del berilo. Sin embargo, el berilio puro no es tan llamativo; luce pálidos brillos grisáceos (imagen superior), y se ha conseguido en forma de pepitas o grageas.
El berilio tiene un conjunto de propiedades físicas características. Tiene una baja densidad; altas conductancias térmica y eléctrica, al igual que su capacidad térmica y disipación del calor; no es un metal magnético; y posee, además, una combinación apropiada de rigidez y elasticidad.
Todas estas propiedades han llevado a que el berilio sea un metal con muchas aplicaciones, que van desde su utilización en aleaciones con cobre para la elaboración de herramientas, hasta su empleo en cohetes, aviones, automóviles, reactores nucleares, equipos de rayos X, resonancia magnética nuclear, etc.
El berilio tiene 10 isótopos conocidos, que van desde 5Be a 14Be, siendo el 9Be el único estable. Asimismo, es un metal muy tóxico, el cual afecta especialmente el sistema respiratorio, por lo que existe una limitación en su uso.
Índice del artículo
- 1 Historia de su descubrimiento
- 2 Estructura del berilio
- 3 Configuración electrónica
- 4 Propiedades
- 4.1 Descripción física
- 4.2 Punto de fusión
- 4.3 Punto de ebullición
- 4.4 Densidad
- 4.5 Radio atómico
- 4.6 Radio covalente
- 4.7 Volumen atómico
- 4.8 Calor específico
- 4.9 Calor de fusión
- 4.10 Calor de evaporación
- 4.11 Electronegatividad
- 4.12 Potencial estándar
- 4.13 Velocidad del sonido
- 4.14 Expansión térmica
- 4.15 Conductividad térmica
- 4.16 Propiedades químicas
- 5 Aplicaciones
- 6 ¿Dónde se encuentra?
- 7 Riesgos
- 8 Referencias
El berilio fue descubierto por Louis-Nicolas Vauguelin en 1798 como elemento composicional del mineral berilo, y un silicato de aluminio y berilio.
Posteriormente, el químico alemán Frederic Wöhler, en 1828, logró aislar el berilio haciendo reaccionar potasio con cloruro de berilio en un crisol de platino.
Simultáneamente, y en forma independiente, el químico francés Antoine Bussy también logró el aislamiento del berilio. Wöhler fue el primero que sugirió el nombre de berilio para el metal.
Recibió su nombre actual en el año de 1957, ya que anteriormente era conocido como glucinio, debido al sabor dulce de algunas sus sales. Pero, para evitar la confusión con otros compuestos de sabor dulce, y con una planta llamada glucina, se decidió cambiarle el nombre por el de berilio.
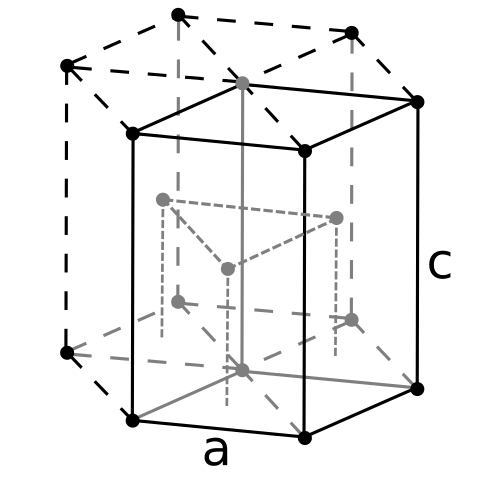
Siendo el berilio el más ligero de los metales alcalinoterrosos, debe esperarse que el volumen de sus átomos sea el más pequeño de todos. Los átomos de berilio interaccionan entre sí mediante el enlace metálico, de tal manera que su “mar de electrones” y las repulsiones entre los núcleos modelen la estructura del cristal resultante.
Se forman entonces los cristales negros de berilio. Estos cristales tienen una estructura hexagonal (imagen superior), donde cada átomo de Be tiene seis vecinos laterales, y otros tres en los planos de arriba y abajo.
Al ser los cristales negros, resulta útil imaginar que se sustituyen los puntos negros de la estructura hexagonal por átomos de berilio. Esta es una de las estructuras más compactas que puede adoptar un metal; y tiene sentido que los átomos tan pequeños de Be se “apretujen” tanto para evitar la menor cantidad de vacío o número de huecos entre ellos.
1s22s2
Lo que es igual a 4 electrones, de los cuales 2 son de valencia. Si se promueve un electrón al orbital 2p, se tendrán dos orbitales híbridos sp. Siendo así, en los compuestos del berilio puede haber geometrías lineales, X-Be-X; por ejemplo, la molécula aislada de BeCl2, Cl-Be-Cl.
Sólido de color gris acerado, brillante y quebradizo.
1287 ºC.
2471 ºC.
– 1,848 g/cm3 a temperatura ambiente.
– 1,69 g/cm3 al punto de fusión (estado líquido).
112 pm.
90 pm.
5 cm3/mol.
1,824 J/g·mol a 20 ºC.
12,21 kJ/mol.
309 kJ/mol.
1,57 en la escala de Pauling.
1,70 V.
12.890 m/s.
11,3 µm/m·K a 25 ºC.
200 w/m·K.
El berilio se recubre de una capa de óxido de berilio (BeO) que le sirve de protección en el aire a temperatura ambiente. La oxidación del berilio ocurre a temperaturas superiores a 1000 ºC, originando como productos óxido de berilio y nitruro de berilio.
Es además resistente a la acción del ácido nítrico 15 M. Pero, se disuelve en ácido clorhídrico y en álcalis, como por ejemplo el hidróxido de sodio.
El berilio forma aleaciones con el cobre, el niquel y el alumino. En particular la aleación con el cobre produce herramientas de gran dureza y resistencia, constituyendo apenas el 2% del peso de la aleación.
Estas herramientas no producen chispas al golpear el hierro, lo cual las capacita para su uso en ambientes con un alto contenido de gases combustibles.
Debido a su baja densidad tiene un peso liviano, lo cual, unido a su rigidez, permite su empleo en aeronaves espaciales, cohetes, misiles y aviones. La aleación con el berilio ha sido utilizada en la elaboración de piezas de automóviles. También ha sido utilizada en la elaboración de resortes.
Debido a la gran dureza que le confiere el berilio a sus aleaciones, estas han sido utilizadas en los frenos de los aviones militares.
El berilio ha sido utilizado en la producción de espejos debido a su estabilidad dimensional y su capacidad de tener una alta pulitura. Estos espejos se usan en satélites y en los sistemas de control de incendios. Además, se usan en los telescopios espaciales.
El berilio es un elemento de baja densidad, por lo que puede considerarse que es transparente a los rayos X. Esta característica permite su uso en la construcción de las ventanas de los tubos que producen los rayos X, de aplicación industrial y en el diagnóstico médico.
Asimismo, se usa el berilio en las ventanas de los detectores de emisiones radiactivas.
Entre las características del berilio, está el no ser un elemento magnético. Esto permite que pueda ser utilizado en la construcción de artículos de los equipos de resonancia magnética, en los cuales se generan campos magnéticos de gran intensidad, minimizándose cualquier interferencia.
Debido a su punto de fusión elevado, ha encontrado aplicación en los reactores nucleares y en la cerámica. El berilio se utiliza como moderador de reacciones nucleares y como productor de neutrones:
9Be + 4He (α) =>12C + n (neutrón)
Se calcula que por un millón de átomos de berilio que se bombardean con partículas α, se producen hasta 30 millones de neutrones. Precisamente esta reacción nuclear permitió el descubrimiento del neutrón.
James Chadwick bombardeó átomos de berilio con partículas α (He). El investigador observó la liberación de unas partículas subátomicas, sin carga eléctrica, lo que llevó al descubrimiento de los neutrones.
Agregar una cantidad de berilio sobre la superficie de los metales que pueden ser oxidados, les confiere una cierta protección. Ppor ejemplo, se reduce la inflamabilidad del magnesio y se prolonga el brillo de las aleaciones de plata.
El berilo es encontrado en la pegmatita, asociado con la mica, el feldespato y el cuarzo. Mediante el uso de una técnica de flotación, se logra separar una mezcla de berilo y feldespato. Posteriormente, el feldespato y el berilo son concentrados y sometidos a un tratamiento con hipoclorito de calcio.
Seguido de un tratamiento con ácido sulfúrico y sulfonato de potasio, mediante de una dilución, se logra la flotación del berilo, separándolo del feldespato.
El berilo es tratado con fluorosilicato de sodio y sosa a 770 ºC para formar fluoroberilato de sodio, óxido de aluminio y dióxido de silicio. Luego se precipita el hidróxido de berilio de la solución de fluoroberilato de sodio con hidróxido de sodio.
El fluoruro de berilio se forma haciendo reaccionar el hidróxido de berilio con fluoruro de hidrógeno amoniacal, produciéndose el tetrafluroberilato de amonio. Este es calentado para formar el fluoruro de berilio, el cual es tratado con magnesio en caliente para aislar el berilio.
El berilio como metal finamente dividido, en forma de soluciones, polvo seco o humo, es muy tóxico y puede producir dermatitis. No obstante, la mayor toxicidad es producida por la inhalación.
Inicialmente, el berilio puede inducir una hipersensibilidad o alergia, la cual puede convertirse en beriliosis o enfermedad crónica del berilio (CBD). Esta es una enfermedad grave, caracterizada por una disminución en la capacidad pulmonar.
La enfermedad aguda es rara. En la enfermedad crónica hay formación de granulomas en todo el cuerpo, especialmente en los pulmones. La beriliosis crónica causa disnea progresiva, tos y debilidad general (astenia).
La beriliosis aguda puede ser mortal. En la beriliosis se produce la pérdida progresiva de la función respiratoria, ya que hay obstrucción en el flujo de los gases en las vías respiratorias y disminución de la oxigenación de la sangre arterial.
- Royal society of Chemistry. (2019). Beryllium. Recuperado de: rsc.org
- National Center for Biotechnology Information. (2019). Beryllium. PubChem Database. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15 de marzo de 2019). Beryllium Facts. Recuperado de: thoughtco.com
- Wikipedia. (2019). Beryllium. Recuperado de: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Recuperado de: lenntech.com
- Materio Corporation. (2019). Learn about the element beryllium Recuperado de: beryllium.com
- D. Michaud. (12 de abril de 2016). Beryllium processing & extraction problem. 911 Metallurgist. Recuperado de: 911metallurgist.com
- Timothy P. Hanusa. (05 de enero de 2016). Beryllium. Encyclopædia Britannica. Recuperado de: britannica.com
- Lee S. Newman. (2014). Enfermedad por berilio. Manual MSD. Recuperado de: msdmanuals.com
