Propiedades físicas y químicas del agua
Las propiedades físicas y químicas del agua son todas aquellas manifestaciones del agua que podemos medir gracias a las interacciones de sus moléculas consigo mismas o sus entornos. Pero, ¿qué es el agua? El agua es una sustancia o molécula química que está formada por la unión de un átomo de oxígeno (O) con dos átomos de hidrógeno (H).
Estos tres átomos se mantienen unidos por la formación de enlaces covalentes, enlaces de tipo muy fuertes y estables. La molécula de agua tiene por fórmula H2O, pudiéndose escribir como H-O-H. Es esta molécula, sus enlaces y sus interacciones son las responsables de que sea una sustancia líquida incolora y sin sabor.

El agua se encuentra en una gran proporción distribuida en toda la Tierra, entre el agua dulce y la salada. El agua es indispensable para que exista la vida en nuestro planeta, ya que es un recurso natural muy valioso. Se encuentra entre un 60 a 70% en los organismos vivos, lo cual es una elevada proporción que les permite cumplir innumerables funciones.
Entre algunas de estas funciones vitales están las estructurales, las reguladoras como el mantenimiento de la temperatura corporal y la regulación del pH (acidez o alcalinidad) dentro de límites normales. Asimismo, el agua realiza el transporte de los nutrientes y desechos en los seres vivos.
También es empleada en muchas áreas del quehacer productivo, tecnológico, científico y de rutina diaria del ser humano; desde el aseo, cocción de alimentos, entre otros usos.
Índice del artículo
Las propiedades físicas del agua se relacionan con las características o magnitudes que se pueden medir o determinar al considerar la materia, como por ejemplo su masa, la energía, entre otras.
Entre las magnitudes físicas del agua están su color, olor, las formas en que se puede encontrar, y todas aquellas que podemos determinar sin que se produzcan reacciones o se altere su composición química.
Al degustar un poco de agua pura a nuestro paladar le resulta que es insabora o sin sabor. Igualmente es inodora o sin olor. Por el proceso de potabilización a veces se le puede percibir un leve olor que se deben a residuos de cloro. Son los minerales los que le conceden al agua distintas cartas de sabores.

El agua en general es incolora y transparente cuando se observa en un vaso de vidrio. Sin embargo, parece que tuviese un ligero color azul claro cuando se acumula en grandes cantidades en envases grandes, o cuando se observa en los glaciares, en los ríos o en los mares.
Y es que de hecho, el agua exhibe cierta coloración azulada pálida, cuya percepción se concentra cuanto mayor sea la cantidad de agua.
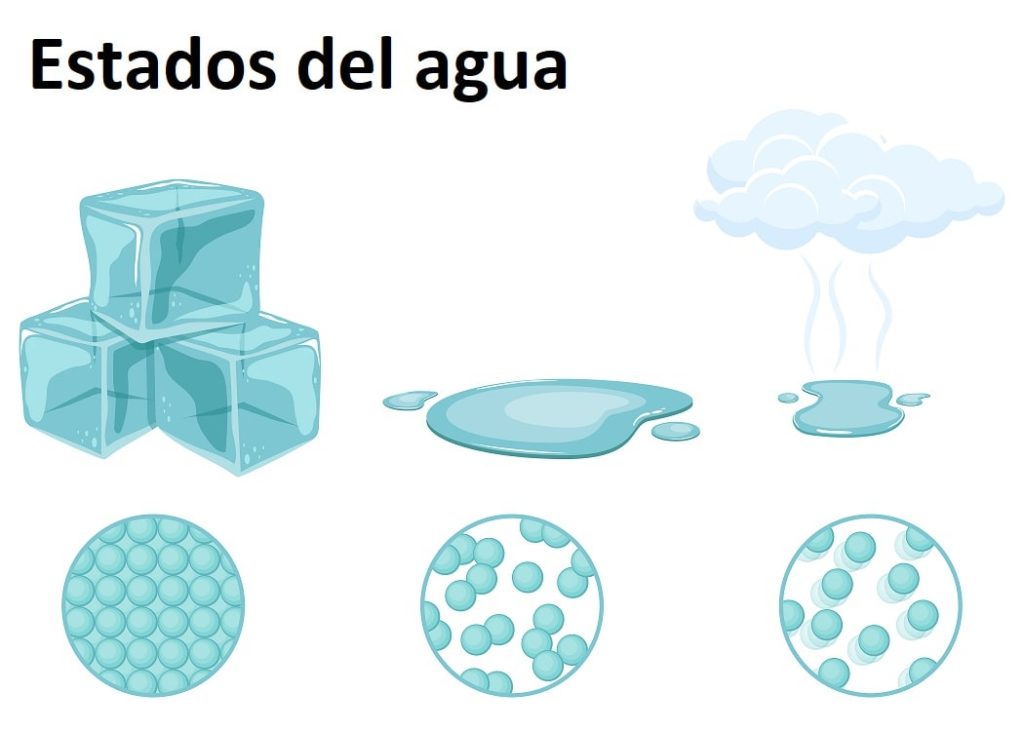
El agua es muy abundante en la Tierra y se puede encontrar en cualquiera de los tres estados de la materia: sólido, líquido o gaseoso. El agua a temperatura ambiente es una sustancia líquida, la cual corresponde a su forma más común.
Como sólido el agua recibe el nombre de hielo o nieve, dependiendo del tamaño de sus cristales y del proceso de su formación. Mientras, el estado gaseoso se forma cuando el agua pasa del estado líquido al gaseoso, formando el famoso vapor de agua, fácilmente reconocible en la cocina y por encima de los alimentos.
La densidad del agua pura oscila alrededor de 1 g/cm3. Mientras, la densidad del agua de mar es un poco mayor debido a la sal que contiene.

El agua se congela a 0 °C. A esta temperatura pasa de su fase líquida a la sólida. Al congelarse el agua se expande. Por eso en su forma sólida posee menor densidad que en su estado líquido, lo cual facilita que el hielo pueda flotar sobre el agua líquida.
Asimismo, esta es la razón por la que al enfriarse el agua en una botella no se debe llenar mucho, ya que el hielo se expande y termina rompiendo la botella.

El agua posee un alto punto de ebullición el cual es de 100 °C. Debe ser sometida a mucho calor para que pueda calentarse y hervir o alcanzar su punto de ebullición.
El agua posee entonces un elevado calor específico, o denominada también capacidad calorífica, que hace que se demore en calentarse; pero también en enfriarse, es decir, es lento el proceso requerido para que pierda el calor adquirido.
Esta propiedad la hace muy útil en los sistemas de refrigeración, en los sistemas de regulación de la temperatura corporal, entre otros relacionados.
El agua es un buen conductor de la electricidad. Por muy pura que sea el agua siempre va a tener alguna cantidad de iones, lo que le confiere la propiedad de poseer una de las constantes dieléctricas más altas entre los líquidos no metálicos.

Las moléculas de agua se mantienen unidas entre sí gracias a los denominados puentes de hidrógeno: enlaces débiles que se establecen entre una y otra molécula de agua. Debido a este elevado nivel de cohesión resulta muy difícil comprimir el agua.

Es fácil que el agua se adhiera por ejemplo a la superficie bien limpia de un vidrio, formando una película, la cual llamamos humedad o “mojado”. Asimismo, el agua se adhiere rápidamente a nuestra piel, por lo cual nos mojamos apenas llueve o nos metemos en una piscina. De lo contrario, nos secaríamos en segundos.

La tensión superficial es la resistencia que ofrece el líquido en su superficie a ser penetrado. El agua posee una elevada tensión superficial, producto de la cohesión que existe entre sus moléculas, lo que la hace formar gotas con facilidad, en vez de esparcirse libremente sobre una superficie lisa.
La tensión superficial se evidencia cuando los insectos parecen desplazarse o caminan sobre el agua sin hundirse, y es la razón por la cual algunas hojas u otros objetos livianos pueden flotar sobre el agua.

La facilidad con que el agua sube o baja por un tubo capilar describe la propiedad de capilaridad del agua. Esta propiedad también se debe a las elevadas propiedades de cohesión y adhesión que tiene el agua.
La capilaridad es aprovechada por la naturaleza vegetal para suministrar agua hasta las hojas de las ramas más altas de un árbol, así como también facilita su absorción por las raíces de las plantas.
Asimismo las propiedades de tensión superficial y capilaridad hacen que el agua forme parte estructural de las células, que forme parte de la sangre, y que corra o fluya fácilmente a través de los diferentes vasos sanguíneos.

El agua puede disolver muchas sustancias, lo cual es vital para los organismos vivos, ya que todas las reacciones químicas de los seres vivos se dan en un medio acuoso. En los organismos vivos sirve de transporte de nutrientes, iones y muchas otras sustancias.
También sirve para el transporte de los desechos, como la urea, que es eliminada en el agua de la orina. Cuando una sustancia se disuelve y se mezcla bien con el agua se dice que es hidrófila o hidrosoluble. Si no se mezcla ni disuelve bien, se dice que la sustancia es hidrófoba o insoluble en agua.
Las propiedades o características químicas son aquellas que se dan cuando se producen cambios en la estructura química del agua. Es importante entonces dar un breve vistazo a su estructura molecular.

El agua es una molécula inorgánica, porque no contiene C (carbono), y su fórmula química es H2O. Sus átomos se unen al compartir electrones formando enlaces covalentes, enlaces fuertes y muy estables. Su masa molar es 18 g/mol, es decir, un mol de agua tiene una masa de 18 gramos.
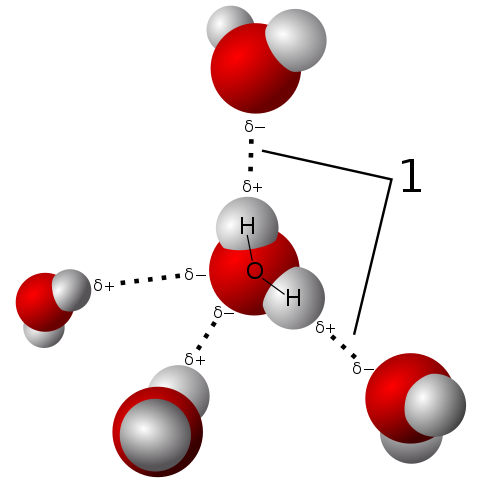
La molécula del agua es neutra, pero presenta cierta polaridad, debido a que el compartir de sus electrones no es tan equitativo.
Como el oxígeno atrae con más fuerza los electrones compartidos hacia sí mismo, la molécula de agua queda con este lado donde está el oxígeno con tendencia a tener cierta carga negativa; y por lo tanto, queda con una carga parcial positiva hacia donde están los hidrógenos (observar la imagen superior).
Esta polaridad facilita la unión entre sí de las moléculas de agua y la unión del agua con otras moléculas que también tienen diferencias de carga en su estructura, lo cual promueve las propiedades físicas descritas en los apartados anteriores.
Espontáneamente en el agua líquida se produce una leve ionización o auto disociación. Significa que algunas de sus moléculas se reorganizan cambiando su estructura molecular normal generando unas nuevas moléculas cargadas eléctricamente, como los iones hidronio (H3O+) e hidroxilo (OH–).
El agua reacciona con muchas sustancias, formando gran diversidad de compuestos químicos. Por electrólisis el agua se puede descomponer separándose el oxígeno de sus dos hidrógenos. Este proceso se produce cuando por el agua pasa una corriente eléctrica. Incluso el agua en su forma solida también puede formar parte de algunas reacciones químicas.

El agua pura tiene un pH neutro (igual a 7), mientras que el agua de mar es levemente alcalina (mayor a 7). El agua de lluvia se acidifica (pH menor a 7) ligeramente cuando se mezcla con los componentes que se encuentren en la atmósfera, como el dióxido de carbono o CO2, por ejemplo.
El agua es anfótera, es decir, puede comportarse como un ácido o como una base dependiendo del pH de la solución. Esta propiedad química apoya su papel como regulador del pH.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Castillero M. O. (2020). Psicología y mente. Las 15 propiedades físicas y químicas del agua. Recuperado de: psicologiaymente.com
- Wikipedia (2020). Properties of water. Recuperado de: en.wikipedia.org
- Sharp K. A. (s.f.). Water: Structure and Properties. Recuperado de: crystal.med.upenn.edu
- BYJU’S. (s.f.). Physical And Chemical Properties Of Water. Recuperado de: byjus.com
- School energy & environment. (s.f.). Water was a resource. Recuperado de: eniscuola.net
