Fuerza de cohesión: concepto, características, ejemplos
¿Qué son las fuerzas de cohesión?
Las fuerzas de cohesión son las fuerzas intermoleculares de atracción que mantienen unidas unas moléculas con otras. Dependiendo de la intensidad de las fuerzas de cohesión una sustancia se encuentra en estado sólido, líquido o gaseoso. El valor de las fuerzas de cohesión es una propiedad intrínseca de cada sustancia.
Esta propiedad está relacionada con la forma y estructura de las moléculas de cada sustancia. Una característica importante de las fuerzas de cohesión es que disminuyen rápidamente cuando aumenta la distancia. Entonces, se denominan fuerzas de cohesión a las fuerzas de atracción que se dan entre las moléculas de una misma sustancia.
Las fuerzas de repulsión son las que resultan de la energía cinética (energía debida al movimiento) de las partículas. Esta energía provoca que las moléculas se encuentren constantemente en movimiento. La intensidad de este movimiento es directamente proporcional a la temperatura a la que se halla la sustancia.
Para provocar el cambio de estado de una sustancia es necesario elevar su temperatura por medio de la transmisión de calor. Esto provoca que aumenten las fuerzas de repulsión de la sustancia, lo cual llegado el caso puede acabar suponiendo que tenga lugar el cambio de estado.
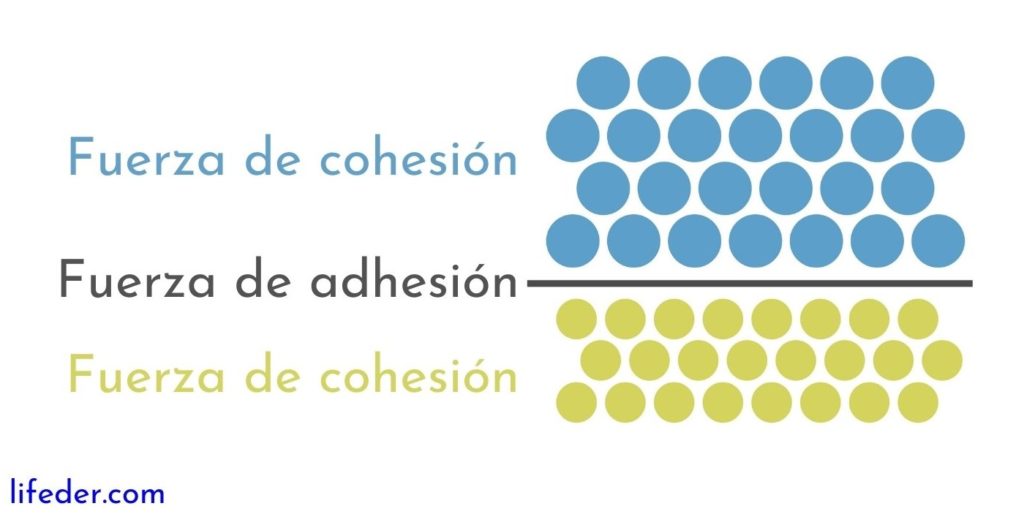
Por otra parte, es importante y necesario distinguir entre la cohesión y la adhesión:
- La cohesión se debe a las fuerzas de atracción que se dan entre partículas adyacentes de una misma sustancia.
- La adhesión es el resultado de la interacción que se produce entre superficies de distintas sustancias o cuerpos.
Estas dos fuerzas aparecen relacionadas en varios fenómenos físicos que afectan a los líquidos, por lo que es importante una buena comprensión tanto de una como de la otra.
Fuerzas de cohesión en los sólidos, líquidos y gases

En los sólidos
En general, en los sólidos las fuerzas de cohesión son muy elevadas y se dan intensamente en las tres direcciones del espacio.
De este modo, si se aplica una fuerza externa sobre un cuerpo sólido únicamente tienen lugar pequeños desplazamientos de las moléculas entre sí.
Además, cuando la fuerza externa desaparece, las fuerzas de cohesión son lo suficientemente fuertes como para volver a situar las moléculas en su posición original, recuperando la posición previa a la aplicación de la fuerza.
En los líquidos
Por el contrario, en los líquidos las fuerzas de cohesión son altas únicamente en dos de las direcciones espaciales, mientras que son muy débiles entre las capas de fluidos.
Así, cuando se aplica una fuerza en una dirección tangencial sobre un líquido, esta fuerza quiebra los débiles enlaces entre las capas. Esto provoca que las capas del líquido se resbalen unas sobre las otras.
Después, cuando concluye la aplicación de la fuerza, las fuerzas de cohesión no cuentan con la fuerza suficiente como para volver a situar las moléculas del líquido en su posición original.
Además, en los líquidos la cohesión también se refleja en la tensión superficial, provocada por una fuerza no equilibrada dirigida hacia el interior del líquido, actuando sobre las moléculas de la superficie.
Igualmente, la cohesión también se observa cuando se da la transición desde el estado líquido al estado sólido, por el efecto de la compresión de las moléculas del líquido.
En los gases
En los gases las fuerzas de cohesión son despreciables. De este modo, las moléculas de los gases se encuentran en constante movimiento, ya que en su caso las fuerzas de cohesión son incapaces de mantenerlas ligadas entre sí.
Por ello, en los gases las fuerzas de cohesión pueden apreciarse tan solo cuando se produce el proceso de licuefacción, que tiene lugar cuando se comprimen las moléculas gaseosas y se dan las fuerzas de atracción lo suficientemente fuertes como para que se produzca la transición del estado gaseoso al estado líquido.
Ejemplos de fuerzas de cohesión
A menudo las fuerzas de cohesión se combinan con las fuerzas de adhesión para dar lugar a determinados fenómenos físicos y químicos.
Por ejemplo, las fuerzas de cohesión junto con las de adhesión permiten explicar algunos de los fenómenos más habituales que se dan en los líquidos; es el caso del menisco, de la tensión superficial y de la capilaridad.
Por tanto, para el caso de los líquidos es necesario distinguir entre las fuerzas de cohesión, que se dan entre las moléculas del mismo líquido; y las de adhesión, que se dan entre las moléculas del líquido y del sólido.
Tensión superficial

La tensión superficial es la fuerza que se da de forma tangencial y por unidad de longitud en el borde de la superficie libre de un líquido que se encuentra en equilibrio. Esta fuerza contrae la superficie del líquido.
En última instancia, la tensión superficial se produce porque las fuerzas que se dan en las moléculas del líquido son diferentes en la superficie del líquido que las que se dan en el interior.
Menisco

Se denomina menisco a la curvatura que se crea en la superficie de los líquidos cuando están confinados en un envase. Esta curva se produce por el efecto que tiene en el líquido la superficie del recipiente que lo contiene.
La curva puede ser convexa o cóncava, dependiendo de si la fuerza entre las moléculas propias del líquido y las del envase son de atracción —como es el caso del agua y el vidrio— o son de repulsión, como ocurre entre el mercurio y el vidrio.
Capilaridad

La capilaridad es una propiedad de los fluidos que les permite ascender o descender por un tubo capilar. Es la propiedad que posibilita, en parte, el ascenso de agua por el interior de las plantas.
Un líquido asciende por el tubo capilar cuando las fuerzas de cohesión son menores que las de adhesión entre el líquido y las paredes del tubo. De este modo, el líquido seguirá subiendo hasta que el valor de la tensión superficial se iguale con el peso del líquido contenido en el tubo capilar.
Por el contrario, si las fuerzas de cohesión son superiores a las de adhesión, la tensión superficial hará descender al líquido y la forma de su superficie será convexa.
Referencias
- Cohesion (Chemistry) (n.d.). In Wikipedia. Recuperado de en.wikipedia.org.
- Surface tension (n.d.). In Wikipedia. Recuperado de en.wikipedia.org.
- Capilaridad (n.d.). In Wikipedia. Recuperado de es.wikipedia.org.
- Ira N. Levine; “Fisicoquímica” Volumen 1; Quinta edición; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chemistry: The Molecular Science. Belmont, CA: Brooks/Cole.
- White, Harvey E. (1948). Modern College Physics. van Nostrand.
