Lipasa: caracaterísticas, estructura, tipos, funciones
Las lipasas constituyen una gran familia de enzimas capaces de catalizar la hidrólisis de los enlaces éster presentes en sustratos como los triglicéridos, los fosfolípidos, los ésteres de colesterol y algunas vitaminas.
Están presentes prácticamente en todos los reinos de la vida, tanto en microorganismos como las bacterias y las levaduras, como en plantas y animales; en cada tipo de organismo estas enzimas tienen propiedades y características especiales que las diferencian unas de otras.
Dependiendo del tipo de clasificación, se puede hacer la distinción entre las “verdaderas” lipasas, también conocidas como triacilglicerol lipasas, y otras enzimas con actividad lipolítica similar como las fosfolipasas, las esterol esterasas y las retinil-palmitato esterasas.
El primer reporte publicado de la secuencia de una enzima lipasa fue el de De Caro y colaboradores en 1981, quienes estudiaron la triacilglicerol lipasa pancreática de porcinos. Estudios posteriores demostraron la existencia de muchas otras lipasas sistémicas en los organismos vivos.
Las lipasas más importantes en los animales son las lipasas digestivas producidas por el páncreas y el hígado, que participan en el metabolismo de las grasas consumidas en la dieta regularmente, y que por ello tienen importantes implicaciones fisiológicas desde diversos puntos de vista.
En la actualidad, estas enzimas no solo se estudian con propósitos clínicos y/o metabólicos, sino que también se producen industrialmente con fines comerciales para el procesamiento de alimentos y otros productos, y se pueden obtener a partir del cultivo de microorganismos especiales.
Índice del artículo
Las lipasas son proteínas solubles en agua y catalizan reacciones hidrolíticas en sustratos insolubles. Se encuentran en la naturaleza en un equilibrio entre su forma activa y su forma inactiva y la activación o inactivación depende de distintos factores celulares internos.
Pertenecen a la superfamilia de enzimas hidrolasas con pliegues α/β, donde también se clasifican las esterasas, las tioesterasas, algunas proteasas y peroxidasas, deshalogenasas y otras hidrolasas intracelulares.
Las lipasas son codificadas por genes que pertenecen a una familia que incluye los genes codificantes de la lipasa pancreática, la lipasa hepática, la lipasa lipoproteica, la lipasa endotelial y la fosfatidilserina fosfolipasa A1.
Algunos autores proponen que la forma de catálisis que tienen estas enzimas es análoga a la de las serín proteasas, lo que se relaciona con la presencia de tres residuos aminoacídicos especiales en el sitio activo.
El mecanismo de hidrólisis implica la formación de un complejo enzima-sustrato (lipasa:triglicérido), subsecuentemente la formación de un intermediario hemiacetal y luego la liberación de un diacilglicérido y un ácido graso.
El último paso de la hidrólisis, la liberación del ácido graso del sitio activo, ocurre por un modelo conocido como el modelo de “catapulta”, que implica que luego del clivaje o la ruptura del enlace éster, el ácido graso es eyectado rápidamente del sitio catalítico.
Las lipasas pueden ser específicas y diferenciar entre sustratos como los triglicéridos, diacilglicéridos, monoglicéridos y fosfolípidos. Algunas son específicas en cuanto a los ácidos grasos, es decir, respecto a su longitud, su grado de saturación, etc.
También pueden ser selectivas en cuanto a la región donde catalizan la hidrólisis, esto quiere decir que pueden tener especificidad posicional respecto al sitio al que se unen las moléculas de ácido graso al esqueleto de glicerol (en cualquiera de los tres carbonos).
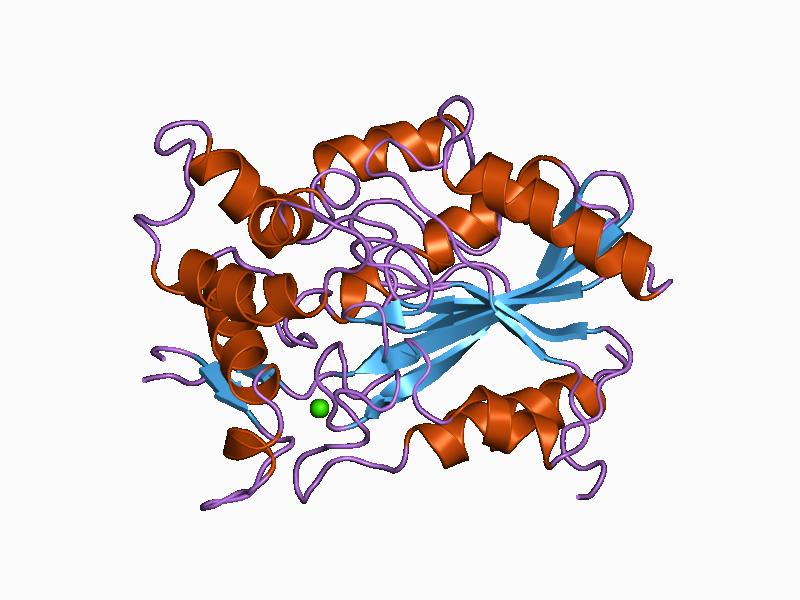
Así como los demás miembros de la familia enzimática a la que pertenecen, las lipasas se caracterizan por una topología compuesta por hélices α y láminas β-plegadas. El sitio catalítico de estas enzimas generalmente está compuesto por una tríada de aminoácidos: serina, ácido aspártico o glutámico e histidina.
La mayor parte de las lipasas son glicoproteínas que, dependiendo del tamaño de la porción carbohidratada, tienen entre 50 y 70 kDa de peso molecular.
Tiene 449 residuos aminoacídicos y dos dominios separados: uno N-terminal, donde se encuentra el sitio catalítico y el pliegue característico de las hidrolasas (α/β), y otro C-terminal, de menor tamaño y considerado “auxiliar”, con una estructura denominada “sándwich β”.
Su peso molecular está entre los 45 y 53 kDa y su actividad catalítica es mayor a temperaturas cercanas a los 37°C y a pH entre 6 y 10.
Dependiendo del órgano donde se encuentren en los mamíferos, por ejemplo, las lipasas ejercen funciones fisiológicas un tanto diferentes.
Como se ha comentado, existen lipasas específicas en el páncreas, en el hígado, los ovarios y las glándulas adrenales (en los riñones) y en los tejidos endoteliales.
Las lipasas hepáticas se encargan del metabolismo de las partículas lipoproteicas, que son complejos formados por lípidos y proteínas que funcionan principalmente en el transporte de triglicéridos y colesterol entre los órganos y tejidos.
Concretamente, las lipasas participan en la hidrólisis o liberación de los ácidos grasos a partir de las moléculas de triglicéridos contenidas en las lipoproteínas. Esto es necesario para extraer energía de estas moléculas o para reciclarlas, empleándolas como precursoras en la síntesis de otros compuestos.
Las lipasas endoteliales están presentes en el hígado, los pulmones, la tiroides y en los órganos reproductivos y la expresión de sus genes está regulada por diferentes citoquinas. Estas enzimas también participan en el metabolismo de lipoproteínas.
En la industria de producción de alimentos lácteos, el uso de las lipasas es común para hidrolizar las grasas presentes en la leche, lo que tiene efectos directos en la “potenciación” del sabor en quesos, cremas y otros productos lácteos.
También son utilizadas en la manufactura de otros productos alimenticios, especialmente durante la fermentación, con el fin de mejorar el sabor y la “digestibilidad” de algunas comidas de preparación industrial.
Lejos de la industria alimenticia, el uso de las lipasas de origen microbiano es popular en la formulación de detergentes y sustancias de limpieza general, que disminuyen los efectos deletéreos sobre el ambiente que conlleva la enorme carga química presente en los productos de limpieza convencionales.
- Lowe, M. E. (2002). The triglyceride lipases of the pancreas. Journal of Lipid Research, 43, 2007–2016.
- Mead, J. R., Irvine, S. A., & Ramji, D. P. (2002). Lipoprotein lipase: structure, function, regulation, and role in disease. J. Mol. Med., 80, 753–769.
- Perret, B., Mabile, L., Martinez, L., Tercé, F., Barbaras, R., & Collet, X. (2002). Hepatic lipase: structure / function relationship, synthesis, and regulation. Journal of Lipid Research, 43, 1163–1169.
- Santamarina-fojo, S., González-navarro, H., Freeman, L., Wagner, E., Santamarina-fojo, S., Gonza, H., … Nong, Z. (2004). Hepatic Lipase, Lipoprotein Metabolism, and Atherogenesis. Arteriosclerosis, Thrombosis, and Vascular Biology, 24, 1750–1754.
- Taylor, P., Kurtovic, I., Marshall, S. N., Zhao, X., Simpson, B. K., Kurtovic, I., … Zhao, X. I. N. (2012). Lipases from Mammals and Fishes. Reviews in Fisheries Science, 29, 37–41.
