Acetato de etilo: estructura, propiedades, síntesis, usos
El acetato de etilo o etanoato de etilo (nombre IUPAC) es un compuesto orgánico cuya fórmula química es CH3COOC2H5. Consiste de un éster, donde el componente alcohólico deriva del etanol, mientras que su componente ácido carboxílico proviene del ácido acético.
Es un líquido bajo condiciones normales de temperatura y presión, presentando un aroma agradable a frutas. Esta propiedad entra perfectamente en armonía por lo que se espera de un éster; que es de hecho la naturaleza química del acetato de etilo. Por esta razón encuentra uso en productos alimenticios y bebidas alcohólicas.
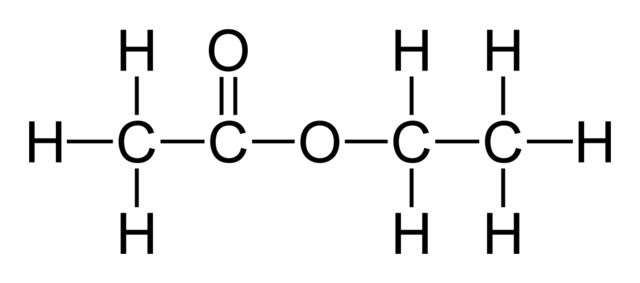
En la imagen superior se muestra el esqueleto estructura del acetatode etilo. Nótese a la izquierda su componente ácido carboxílico, y a la derecha el componente alcohólico. Desde un punto de vista estructural, podría esperarse que este compuesto se comportara como un híbrido entre el vinagre y el alcohol; sin embargo, exhibe propiedades propias de él.
Es aquí donde tales híbridos llamados ésteres se destacan por ser diferentes. El acetato de etilo no puede reaccionar como un ácido, ni tampoco deshidratarse por la ausencia de un grupo OH. En lugar de eso, sufre hidrólisis básica en presencia de una base fuerte, como hidróxido de sodio, NaOH.
Esta reacción de hidrólisis se utiliza en los laboratorios de docencia para los experimentos de cinética química; donde la reacción, además, es de segundo orden. Cuando ocurre la hidrólisis, prácticamente el etanoato de etilo regresa a sus componentes iniciales: el ácido (desprotonado por el NaOH), y el alcohol.
En su esqueleto estructural se observa que predominan los átomos de hidrógeno sobre los de oxígeno. Esto influye en su capacidad para interaccionar con especies no tan polares como las grasas. Asimismo, se emplea para disolver compuestos como las resinas, colorantes, y en general sólidos orgánicos.
A pesar de tener un aroma agradable, una prolongada exposición a este líquido genera un impacto negativo (como casi todas los compuestos químicos) en el organismo.
Índice del artículo
- 1 Estructura del acetato de etilo
- 2 Propiedades físicas y químicas
- 2.1 Nombres
- 2.2 Fórmula molecular
- 2.3 Peso molecular
- 2.4 Descripción física
- 2.5 Color
- 2.6 Olor
- 2.7 Sabor
- 2.8 Umbral de olor
- 2.9 Punto de ebullición
- 2.10 Punto de fusión
- 2.11 Solubilidad en agua
- 2.12 Solubilidad en solventes orgánicos
- 2.13 Densidad
- 2.14 Densidad del vapor
- 2.15 Estabilidad
- 2.16 Presión de vapor
- 2.17 Viscosidad
- 2.18 Calor de combustión
- 2.19 Calor de vaporización
- 2.20 Tensión superficial
- 2.21 Indice de refracción
- 2.22 Temperatura de almacenamiento
- 2.23 pKa
- 3 Síntesis
- 4 Usos
- 5 Riesgos
- 6 Referencias
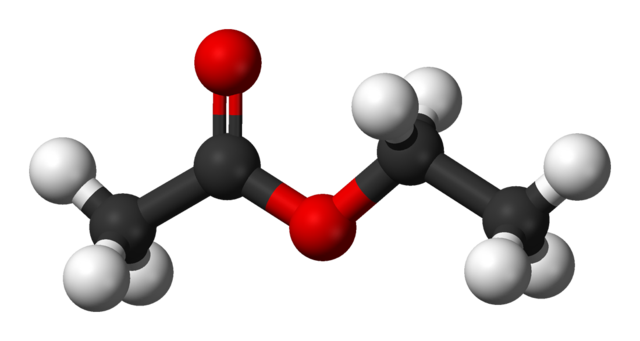
En la imagen superior se muestra la estructura del acetato de etilo con un modelo de esferas y barras. En este modelo se resaltan los átomos de oxígeno con esferas rojas; a su izquierda está la fracción derivada del ácido, y a su derecha la fracción derivada del alcohol (grupo alcoxi, –OR).
El grupo carbonilo se aprecia por el enlace C=O (las dobles barras). La estructura entorno a este grupo y el oxígeno adyacente es plana, debido a que hay una deslocalización de la carga por resonancia entre ambos oxígenos; hecho que explica una relativamente baja acidez de los hidrógenos α (los del grupo –CH3, enlazado al C=O).
La molécula al rotar dos de sus enlaces, favorece directamente en cómo interacciona con otras moléculas. La presencia de los dos átomos de oxígeno, y la asimetría en la estructura, le confieren un momento dipolar permanente; que a su vez, es responsable de sus interacciones tipo dipolo-dipolo.
Por ejemplo, la densidad electrónica es mayor cerca de los dos átomos de oxígeno, disminuyendo considerablemente en el grupo –CH3, y paulatinamente en el grupo OCH2CH3.
Debido a estas interacciones, las moléculas de acetato de etilo forman un líquido en condiciones normales, el cual tiene un punto de ebullición considerablemente alto (77ºC).
Si se observa detenidamente la estructura, se notará la ausencia de un átomo capaz de donar un puente de hidrógeno. Sin embargo, los átomos de oxígeno son aceptores de tal, y por el acetato de etilo es muy soluble en agua, e interacciona en un grado estimable con compuestos polares y donadores de puentes de hidrógeno (como los azúcares).
Asimismo, esto le permite interaccionar excelentemente con el etanol; razón por la cual no se extraña su presencia en las bebidas alcohólicas.
Por otro lado, su grupo alcoxi lo vuelve capaz de interaccionar con ciertos compuestos apolares, tales como el cloroformo, CH3Cl.
-Acetato de etilo
-Etanoato de etilo
-Éster etil acético
-Acetoxietano
C4H8O2 o CH3COOC2H5
88,106 g/mol.
Líquido incoloro claro.
Líquido incoloro.
Característico de los éteres, semejante al olor de la piña.
Agradable cuando se diluye, aporta un sabor a fruta a la cerveza.
3,9 ppm. 0,0196 mg/m3 (olor bajo); 665 mg/m3 (olor alto).
Olor detectable a 7 – 50 ppm (media = 8 ppm).
171 ºF a 760 mmHg (77,1 ºC).
-118,5 ºF (-83,8 ºC).
80 g/L.
Miscible con etanol y éter etílico. Muy soluble en acetona y benceno. Miscible además con cloroformo, aceites fijo y volátiles, y también con solventes oxigenados y clorinados.
0,9003 g/cm3.
3,04 (en relación aire:1).
Se descompone lentamente con la humedad; incompatible con varios plásticos y agentes oxidantes fuertes. La mezcla con el agua puede ser explosiva.
93,2 mmHg a 25 ºC
0,423 mPoise a 25 ºC.
2.238,1 kJ/mol.
35,60 kJ/mol a 25 ºC.
24 dinas/cm a 20 ºC.
1,373 a 20 ºC/D.
2 – 8 ºC.
16 – 18 a 25 ºC.
El etil acetato es sintetizado industrialmente mediante la reacción de Fisher, en la cual se esterifica el etanol con el ácido acético. La reacción se realiza a temperatura ambiente.
CH3CH2OH + CH3COOH => CH3COOCH2CH3 + H2O
La reacción se acelera por catálisis ácida. El equilibrio se desplaza a la derecha, es decir, hacia la producción de etil acetato, mediante la remoción de agua; de acuerdo a Ley de Acción de Masa.
También se prepara industrialmente el acetato de etilo empleando la reacción de Tishchenko, conjugándose dos equivalentes de acetaldehído con el uso de un alcóxido como catalizador.
2 CH3CHO => CH3COOCH2CH3
-Se sintetiza acetato de etilo como un coproducto en la oxidación de butano a ácido acético, en una reacción realizada a una temperatura de 175 ºC y 50 atm de presión. Se usa como catalizador al cobalto e iones de cromo.
-El acetato de etilo es un coproducto de la etanólisis del acetato de polivinilo a alcohol polivinílico.
-También se produce en la industria el acetato de etilo mediante la deshidrogenación de etanol, catalizándose la reacción mediante el uso del cobre a una temperatura elevada, pero inferior a 250 ºC.
El acetato de etilo es utilizado como disolvente y diluyente, usándose en la limpieza de tableros de circuitos. Se usa como solvente en la fabricación del extracto de lúpulo modificado, y en el descafeinado del café y de las hojas de té. Se utiliza en las tintas usadas para marcar frutas y verduras.
El acetato de etilo es empleado en la industria textil como un agente limpiante. Es utilizado en la calibración de termómetros, usados en la separación de azúcares. En la industria de las pinturas se usa como disolvente y diluyente de los materiales utilizados.
Se utiliza en la elaboración de sabores de frutas; por ejemplo: banana, pera, durazno y piña, así como aroma de uva, etc.
Se usa en la determinación de bismuto, boro, oro, molibdeno y platino, así como disolvente del talio. El acetato de etilo tiene la capacidad de extraer muchos compuestos y elementos presentes en solución acuosa, tales como: fósforo, cobalto, tungsteno y arsénico.
El acetato de etilo se emplea en la industria como un reductor de la viscosidad de las resinas utilizadas en las formulaciones fotorresistentes. Se usa en la producción de acetamida, acetato de acetilo y metil heptanona.
En los laboratorios se utiliza el acetato de etilo como fase móvil de las cromatografías en columnas y como solvente de extracción. Al tener el acetato de etilo un punto de ebullición relativamente bajo, es de fácil evaporación, lo que permite concentrar las sustancias disueltas en el solvente.
El acetato de etilo se utiliza en entomología para asfixiar los insectos colocados en un recipiente, lo que permite su recolección y estudio. Los vapores de acetato de etilo matan al insecto sin destruirlo y evitando su endurecimiento, facilitando su montaje para colección.
-El LD50 del acetato de etilo en ratas, indica una toxicidad baja. Sin embargo, puede irritar la piel, los ojos, la piel, la nariz y garganta.
-La exposición a niveles elevados puede causar mareo y desmayo. Asimismo, la exposición a largo plazo puede afectar el hígado y el riñón.
-La inhalación de acetato de etilo a una concentración de 20.000 – 43.000 ppm, puede producir edema pulmonar y hemorragia.
-El límite de exposición laboral, ha sido fijado por la OSHA en 400 ppm en el aire, como promedio, durante un turno laboral de 8 horas.
- Steven A. Hardinger. (2017). Illustrated Glossary of Organic Chemistry: ethyl acetate (EtOAc). Recuperado de: chem.ucla.edu
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Morrison, R. T. y Boyd, R. N. (1990). Química Orgánica. (5ta edición). Editorial Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Ethyl acetate. Recuperado de: en.wikipedia.org
- Cotton S. (s.f.). Ethyl acetate. Recuperado de: chm.bris.ac.uk
- PubChem. (2019). Ethyl acetate. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Newseed Chemical. (2018). Applications and uses of ethyl acetate. Recuperado de: foodsweeteners.com
- New Jersey Department of Health of Senior Services. (2002). Acetato de etilo. [PDF]. Recuperado de: nj.gov
