Agar Thayer Martin: fundamento, preparación y usos
El agar Thayer Martin es un medio sólido altamente nutritivo y selectivo para el aislamiento de Neisseria meningitidis y Neisseria gonorrhoeae; ambas conocidas como Neisserias patógenas o de importancia clínica.
Una de las características especiales más importantes que presenta el agar Thayer Martin es su alto contenido en suplementos nutritivos. Esta propiedad es indispensable, debido a que las Neisserias son microorganismos muy exigentes desde el punto de vista nutricional y por tanto no crecen en medios comunes.
Por otra parte, debido a que estos microorganismos normalmente se encuentran en áreas no estériles es necesaria la adición de inhibidores que impidan el crecimiento de la flora acompañante, sin que esto afecte al desarrollo del género Neisseria.
Este agar está compuesto por agar base GC, hemoglobina, suplementos nutricionales adicionales y un complejo de sustancias inhibidoras (antibióticos y antifúngicos). Las casas comerciales expenden cada uno de los suplementos por separado.
La muestra a sembrar en este medio dependerá del microorganismo que se esté buscando. Para Neisseria gonorrhoeae las muestras ideales son secreciones vaginales y uretrales. Mientras que para Neisseria meningitidis las muestras más usadas son LCR, exudados faríngeo y nasofaríngeos.
Índice del artículo
Las Neisserias son microorganismos catalogados como fastidiosos y por tanto su aislamiento es difícil. Por ello, el Thayer Martín es un medio complejo y cada uno de sus componentes cumple una función que a continuación se explican:
El agar GC contiene proteosa peptona, almidón de maíz, cloruro de sodio, fosfato dipotásico, fosfato monopotásico y agar-agar. Sus componentes aportan los nutrientes básicos para el desarrollo microbiano, neutralizan los ácidos grasos tóxicos, contribuyen a mantener el balance osmótico, definen el pH y brindan la consistencia sólida al medio.
La hemoglobina brinda los factores V y X (nicotinamida adenina dinucleótido NAD y hemina respectivamente). Por ello en este medio también crecen especies de Haemophilus. La hemoglobina puede ser obtenida comercialmente de forma deshidratada o puede adicionarse sangre bovina fresca desfibrinada al medio.
Por otra parte, al medio Thayer-Martin también se le debe adicionar un suplemento de enriquecimiento, ya que los nutrientes que contiene el agar base no son suficientes para los requerimientos del género Neisseria.
El suplemento de enriquecimiento más comúnmente utilizado se llama isovitalex. Este contiene glutamina, adenina, NAD, cocarboxilasa, guanina, nitrato férrico, ácido p-amino benzóico, vitamina B12, tiamina y glucosa. Todos estos compuestos son necesarios para el buen desarrollo de las Neisserias patógenas.
Por ser un medio altamente nutritivo se deben utilizar inhibidores que impidan el crecimiento de microorganismos de la flora habitual del área y así favorecer el aislamiento del género Neisseria.
El complejo de inhibidores está compuesto por vancomicina, colistina y nistatina. La vancomicina inhibe el crecimiento de bacterias Gram positivas, la colistina impide el desarrollo de bacterias Gram negativas como Pseudomonas y algunas Neisserias saprófitas, y la nistatina actúa sobre las levaduras como Candida albicans.
Sin embargo, luego se modificó el agar Thayer Martin; los cambios consistieron en la adición de trimetoprim, el aumento en la cantidad de agar y el agregado de glucosa extra. Estos cambios mejoraron significativamente la recuperación de las especies de Neisseria gonorrhoeae.
Cabe destacar que el trimetoprim inhibe el crecimiento del género Proteus y su consecuente formación de swarming. En este sentido, los antibióticos son los que proveen el carácter selectivo al medio Thayer Martin.
-Agar GC
Pesar 8,2 gr del medio GC deshidratado y suspender en 100 ml. Mezclar y hervir por 1 minuto con agitación frecuente para disolver en su totalidad. Esterilizar la mezcla en autoclave a 121°C por 15 minutos.
-Hemoglobina al 2%
Suspender 2 gr de hemoglobina deshidratada en 2 o 3 ml de agua destilada caliente hasta formar una mezcla uniforme. Adicionar poco a poco más agua hasta completar un volumen de 100 ml. La suspensión debe quedar homogénea antes de esterilizar.
Esterilizar en autoclave por 15 minutos.
-Suplemento de enriquecimiento
Reconstituir el vial comercial con el diluente proporcionado por la misma casa comercial. Mezclar bien. La cantidad de diluente a usar será especificada en el instructivo del kit.
-Suplemento de inhibición V.C.N (vancomicina, colistin, nistatina)
Reconstituir el vial con el diluente provisto por la casa comercial. Mezclar bien. La cantidad de diluente a usar será especificada en el instructivo del kit.
-Preparado
Por cada 100 ml de agar GC proceder de la siguiente manera:
Al salir del autoclave el agar GC, dejar enfriar hasta una temperatura aproximada de 50°C y adicionar 2 ml de la solución de hemoglobina preparada, 2 ml del suplemento de enriquecimiento (isobitalex o britalex), y 2 ml del suplemento de inhibición. Mezclar y servir en placas de Petri estériles.
Dejar solidificar y guardar en nevera hasta su uso.
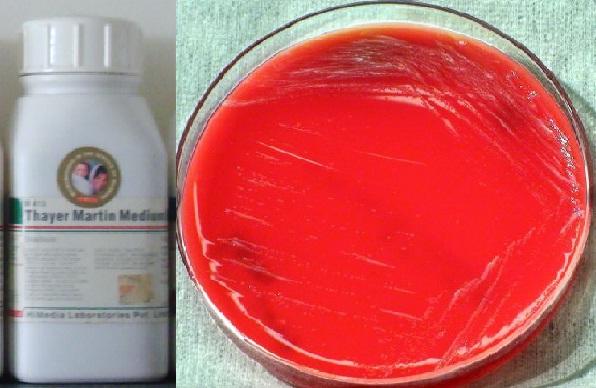
El color del medio preparado es rojo cereza. El pH final del medio es de 7,2 ± 0,2
Pesar 8,2 gr del medio GC deshidratado y suspender en 100 ml. Agregar 1 gr de agar-agar y adicionar 0,3 gr de glucosa. Mezclar y hervir por 1 minuto con agitación frecuente para disolver en su totalidad. Esterilizar la mezcla en autoclave a 121°C por 15 minutos.
Preparar la hemoglobina y el suplemento de enriquecimiento como fue descrito anteriormente.
El suplemento de inhibición utilizado es V.C.N.T (vancomicina, colistin, nistatina, trimetoprim).
-Preparado
Proceder de la forma descrita para el agar Thayer Martin original.
El agar Thayer Martin debe dejarse atemperar antes de sembrar las muestras. Las muestras comúnmente utilizadas son exudados faríngeos, exudados nasales, secreción vaginal, uretral y/o rectal y LCR.
Utilizar muestras recién tomadas y hacer inóculos fuertes sobre el agar. Las muestras se siembran directamente por descarga de material y luego se estría por agotamiento sobre la superficie.
Las placas se incuban a 35-37°C por 24 a 48 horas en jarra de microaerofilia (5% CO2). Terminado el tiempo de incubación se examinan las placas en busca de colonias pequeñas, color gris y algunas veces de aspecto mucoide.
Realizar Gram y las pruebas bioquímicas confirmatorias a las colonias sospechosas.
Para realizar el control de calidad al agar Thayer Martin se pueden usar las siguientes cepas microbianas.
Neisseria gonorrhoeae ATCC 49226 y Neisseria meningitidis ATCC 13090; en ambas cepas se espera un desarrollo satisfactorio.
También se deben incluir las siguientes cepas: Staphylococcus epidermidis ATCC 14990, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071 y Candida albicans ATCC 10231. En todas ellas se espera una inhibición total o parcial en este medio.
-Hay que tener presente que en el medio pueden crecer bacterias que sean resistentes a los inhibidores utilizados.
-Existen cepas de Neisseriagonorrhoeae que pueden ser sensibles a la concentración de vancomicina utilizada. Por este motivo se recomienda utilizar paralelamente agar chocolate suplementado con isovitalex, pero sin inhibidores.
-Existen cepas de levaduras resistentes a nistatina que pueden crecer en este medio e interferir en el aislamiento de las Neisserias patógenas, especialmente los gonococos.
- Laboratorios Valtek diagnostic. Agar Thayer-Martin.2016. Disponible en: com
- Laboratorios Britania. Thayer Martin Medio Modificado. 2010. Disponible en:britanialab.com
- Wikipedia contributors. Thayer-Martin agar. Wikipedia, The Free Encyclopedia. October 26, 2017, 16:33 UTC. Available at: wikipedia.org4. Accessed February 28, 2019.
- Laboratorios Britania. Agar GC. 2010. Disponible en: britanialab.com.
- Laboratories BBL™ Medium Enrichment for Fastidious Microorganisms. 1999. Available in: bd.com
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
