Concentración porcentual: concepto, características, cálculo, ejemplos
¿Qué es la concentración porcentual?
La concentración porcentual es una manera de expresar la relación del soluto en cien partes de mezcla o disolución. Cabe resaltar que estas “partes” pueden expresarse en unidades de masa o de volumen. Gracias a esta concentración, se conoce la composición de una disolución la cual, a diferencia de la de un compuesto puro, no es constante.
Asimismo, no solo su composición varía, sino también sus propiedades organolépticas. El tarro de té de la imagen inferior adquiere sabores (y coloraciones) más intensas a medida que se disuelve más especias en el agua helada. Sin embargo, aunque sus propiedades cambien, la concentración de estas especias se mantiene constante.
Si suponemos que se disuelven 100 gramos de estas en agua y después se agita lo suficiente para homogeneizar la solución, se distribuirán los gramos por todo el tarro. La concentración porcentual del té permanece constante aun si se divide el contenido líquido en distintos recipientes.
Esto variará solo si se adiciona más agua al tarro, lo cual, aunque no modifique la masa original de las especias disueltas (soluto), sí modifica su concentración. Para el ejemplo de la tasa de té, esta concentración puede expresarse convenientemente en masa de soluto entre volumen de agua.
Así, se abre paso a los infinitos casos donde estos cálculos de concentración juegan un papel crucial.
¿Qué es una solución?
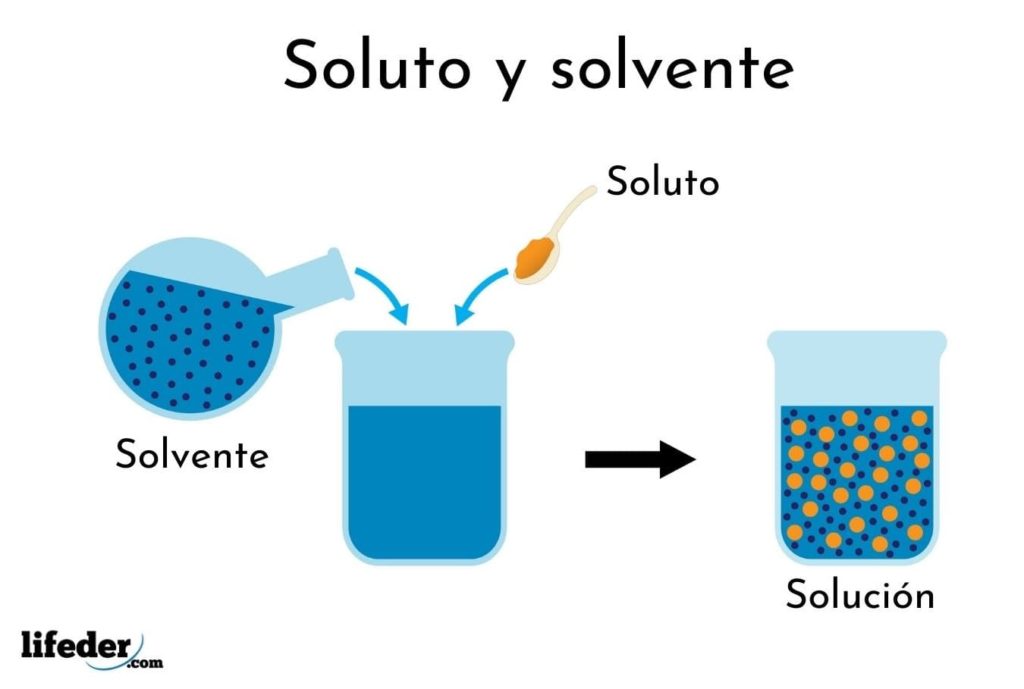
Es necesaria la comprensión del término “solución” antes de abordar las expresiones porcentuales de su concentración.
Una solución es una mezcla homogénea o uniforme de dos o más sustancias cuyas partículas son del tamaño atómico o molecular.
Los componentes de esta son el soluto y el solvente. El soluto es el material disuelto en una solución, el cual se encuentra en menor proporción. El solvente es el medio de dispersión en una solución y se encuentra en mayor proporción (como el agua en el tarro de té).
Características de la concentración porcentual
– La concentración porcentual presenta la comodidad de evitar los cálculos de molaridad y otras unidades de concentración. En muchos casos, basta conocer la cantidad de soluto disuelto en la solución. Sin embargo, para las reacciones químicas se deja un lado por la concentración molar.
– Facilita la comprobación de la ley de conservación de la masa.
– Se expresa en partes por cien de solución, dentro de las cuales se cuenta el soluto.
– La relación entre el soluto y la solución puede expresarse en unidades de masa (gramos) o de volumen (mililitros).
¿Cómo se calcula?
La manera de calcularla depende de las unidades en que se desea expresarla. No obstante, el cálculo matemático es en esencia el mismo.
Tanto por ciento peso en peso % m/m
% (m/m) = (gramos de soluto / gramos de solución) ∙ 100
El tanto por ciento en peso de una solución indica el número de gramos de soluto en cada 100 gramos de solución.
Por ejemplo, una solución al 10 % m/m de NaOH contiene 10 gramos de NaOH por 100 gramos de solución. También puede interpretarse de este modo: 10 g de NaOH se disuelven en 90 g de agua (100-10).
Tanto por ciento peso en volumen % m/v
% (m/v)= (gramos de soluto / mililitros de solución) ∙ 100
El tanto por ciento en miligramos es una unidad de concentración utilizada con frecuencia en los informes clínicos para describir las concentraciones extremadamente bajas del soluto (por ejemplo, trazas minerales en la sangre).
Como un caso concreto, se tiene el siguiente ejemplo: el nivel de nitrógeno en la sangre de una persona es de 32 mg%, lo que significa que hay 32 mg de nitrógeno disuelto por cada 100 ml de sangre.
Tanto por ciento volumen en volumen % v/v
% (v/v) = (mililitros de soluto / mililitros de solución) ∙ 100
El tanto por ciento volumen en volumen de una solución indica el número de mililitros de soluto en cada 100 mililitros de solución.
Por ejemplo, una solución al 25%v/v de alcohol en agua, contiene 25 mililitros de alcohol por 100 mililitros de solución, o lo que es lo mismo: 75 mL de agua disuelven 25 mL de alcohol.
Ejemplos de cálculos de concentración porcentual
Ejemplo 1
Si se cuentan con 7 g de KIO3, ¿cuántos gramos de disolución al 0,5 % m/m pueden prepararse con esta cantidad de sal?
Una solución al 0,5 % m/m es muy diluida, y se interpreta como sigue: por cada 100 gramos de solución hay 0,5 gramos de KIO3 disueltos. Entonces, para determinar los gramos de esta disolución que pueden prepararse, se hace uso de los factores de conversión:
7 g KIO3 ∙ (100 g Sol/ 0.5 g KIO3) = 1400 g o 1.4 Kg de solución.
¿Cómo es posible? Evidentemente, la gran cantidad de masa provino del agua; así, los 7 gramos de KIO3 se disolvieron en 1393 gramos de agua.
Ejemplo 2
Si se desea preparar 500 gramos de una solución de CuSO4 al 1 %, ¿cuántos gramos de la sal cúprica son necesarios?
Se aplican los factores de conversión para despejar los g de CuSO4 deseados:
500 g de Sol CuSO4 ∙ (1 g de CuSO4/ 100 g de Sol CuSO4) = 5 g de CuSO4
Es decir, que se disuelven 5 g de CuSO4 (una sal de brillantes colores azulados) en 495 g de agua (aproximadamente 495 mL)
Ejemplo 3
Si se mezclan 400 mL de agua, 37 gramos de azúcar, 18 gramos de sal y 13 gramos de sulfato de sodio (Na2SO4), ¿cuál es la concentración porcentual en masa para cada uno de los componentes de la mezcla?
Si se asume que la densidad del agua es 1g/ mL, entonces la mezcla dispone de 400 g de agua. Sumando la masa total de los componentes de la solución se tiene: (400 + 37 + 18 + 13 )= 468 g de solución.
Aquí el cálculo es directo y simple:
%Agua m/m= (400 g agua/ 468 g Sol) ∙ 100 = 85.47
%Azúcar m/m= (37 g azúcar/ 468 g Sol) ∙ 100 = 7.90
%Sal m/m = (18 g sal/ 468 g Sol) ∙ 100 = 3.84
%Na2SO4 m/m = (13 g Na2SO4/ 468 g Sol) ∙ 100 = 2.77
Sumando todos los porcentajes másicos individuales se tiene: (85,47 + 7,90 + 3,84 + 2,77) = 99,98 % ≈ 100 %, la mezcla total.
