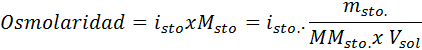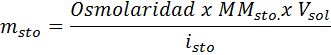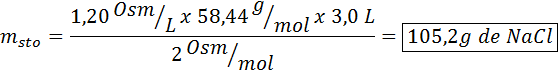Osmolaridad: concepto, cómo se calcula, ejemplos
¿Qué es la osmolaridad?
La osmolaridad es una unidad de concentración que indica la concentración molar del conjunto de partículas osmóticamente activas presentes en una solución. Dicho de otra forma, la osmolaridad es la molaridad de las partículas osmóticamente activas.
Se define como partícula osmóticamente activa a aquella molécula neutra o ion que no puede atravesar una membrana semipermeable, tal como la membrana celular. La presencia de este tipo de partículas genera presión osmótica en la solución, y de allí su nombre.
Al número de moles de partículas osmóticamente activas se le denomina osmoles (representados por el símbolo Osm), por lo que la osmolaridad viene expresada en unidades de Osm/L.
La importancia de la osmolaridad
La osmolaridad es un concepto de mucha importancia para la biología y la medicina, ya que el equilibrio osmótico de las células con su entorno es esencial para su supervivencia. Por ejemplo, inyectar una solución con una osmolaridad muy alta o muy baja por vía intravenosa, fácilmente puede causarle la muerte a un paciente.
Por otro lado, una técnica muy común que utilizan los biólogos celulares para romper células de distintos tipos es por medio de la lisis osmótica. Esto consiste en colocar las células en una solución hipotónica (con una osmolaridad muy baja) para que el agua de la solución las penetre por ósmosis y las haga reventar.
Esto hace que sea muy importante, tanto para médicos como para biólogos y profesionales de otras áreas, conocer, medir o saber calcular la osmolaridad de una solución.
Diferencias entre osmolaridad y osmolalidad
Al hablar sobre osmolaridad, es necesario hablar también sobre la osmolalidad. La osmolalidad es similar a la osmolaridad, de la misma forma en que la molalidad es similar a la molaridad.
Mientras que la osmolaridad indica el número de osmoles por cada litro de solución (Osm/L), la osmolalidad indica lo mismo, pero por cada kilogramo de solvente (Osm/kg).
La osmolalidad tiene la ventaja de que, al no depender del volumen de la solución, tampoco depende de la densidad ni de la temperatura. Por esta razón, una solución tendrá la misma osmolalidad a 25°C que a 37°C. En cambio, su osmolaridad a 37°C será ligeramente menor que su osmolaridad a 25°C, debido al aumento de volumen por expansión térmica.
La osmolalidad suele ser más fácil de medir experimentalmente que la osmolaridad. Sin embargo, la osmolaridad es más fácil de calcular y es una unidad más fácil de trabajar cuando se preparan diluciones.
¿Cómo se calcula la osmolaridad de una solución?
Existen varias formas de calcular la osmolaridad de una solución, dependiendo de la información con la que se cuente. Se puede calcular a partir de:
- Las cantidades de soluto y solución.
- La molaridad de los solutos presentes.
- Las concentraciones de iones individuales.
- El porcentaje m/V de los solutos, entre otros.
En todos los casos, el cálculo se basa en la fórmula general de la osmolaridad, que es:

Donde nOsm es el número de osmoles presentes en la solución y Vsol es el volumen de la misma expresado en litros. El número de osmoles se calcula multiplicando el número de moles del soluto por el número de partículas en las cuales se disocia en solución.
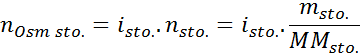
En esta ecuación, nsto es el número de moles de soluto, msto es su masa (en g), MMsto es su masa molar (en g/mol) e isto es el coeficiente de Van ‘t Hoff del soluto. Este coeficiente tiene un valor de 1 para los solutos no electrolitos (como la glucosa, por ejemplo).
Para los electrolitos fuertes que se disocian completamente (como el cloruro de sodio, NaCl) el coeficiente de Van ‘t Hoff es igual al número total de iones en los que se disocia cada mol del compuesto.
Por ejemplo, en el caso del sulfato de potasio, K2SO4, cuya reacción de disociación es:
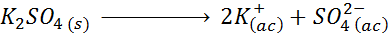
cada mol de la sal que se disuelve produce 3 moles de iones (2 iones K+ y 1 ion SO42-), por lo que i = n = 3.
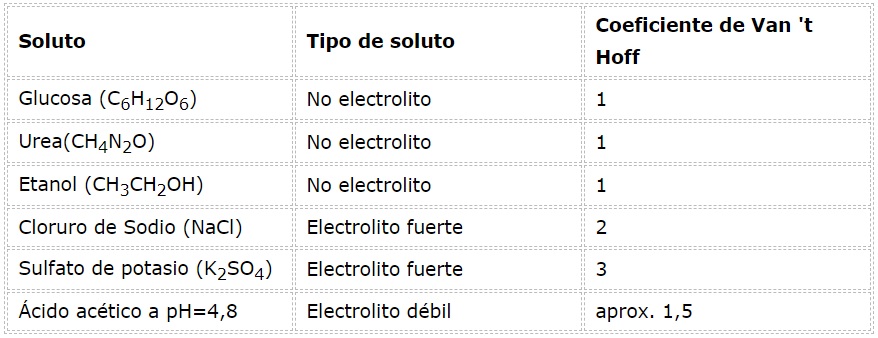
En el caso de electrolitos débiles el cálculo es más complicado, pero se suelen determinar experimentalmente. En la siguiente tabla se resumen los coeficientes de Van ‘t Hoff para algunos solutos comunes.
Ejemplos del cálculo de osmolaridad
1. Ejemplo 1
Determinar la osmolaridad de una solución preparada disolviendo 10 g de NaCl y 10 g de glucosa en 100 mL de solución
Solución: En este caso, se calculan por separado los osmoles de cada soluto y luego se suman. Las masas molares son 58,45 g/mol y 180 g/mol respectivamente, y los coeficientes de Van ‘t Hoff son 2 y 1:
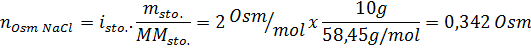
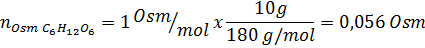
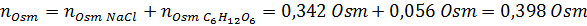
Ahora calculamos la osmolaridad utilizando la fórmula, sabiendo que 100 mL equivalen a 0,100L:
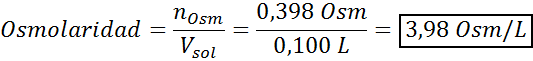
Finalmente, la osmolaridad de la solución es de 3,98 Osm/L.
2. Ejemplo 2
Determinar la osmolaridad de una solución 0,05 molar de sulfato de potasio.
Solución: Si ya conocemos la molaridad del soluto, calcular la osmolaridad es tan sencillo como multiplicar dicha concentración por el factor de Van ‘t Hoff.
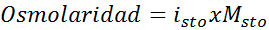
En este caso, el factor para la sal es 3.
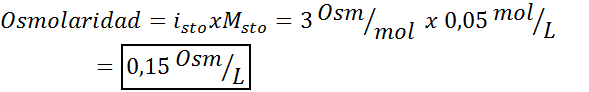
3. Ejemplo 3
Determinar la osmolaridad de una muestra de plasma que contiene 0,125 M de iones sodio, 0,020 M de iones potasio y 0,145 de iones cloruro.
Solución: La osmolaridad de los iones individuales son iguales a su molaridad, ya que los iones no se disocian más y tienen un i=1. Por esta razón, en este caso solo hace falta multiplicar por i=1 cada concentración y sumar:
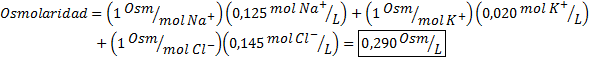
4. Ejemplo 4
Calcule la osmolaridad de una solución que contiene 27 mg de CaCl2.2H2O por cada 10 mL de solución
Solución: El peso molecular del CaCl2.2H2O es 147 g/mol. Al disolverse, esta sal se separa en 2 moléculas de agua y tres iones. Sin embargo, las moléculas de agua no son partículas osmóticamente activas por lo que no se toman en cuenta para el cálculo de la osmolaridad, y el coeficiente para este compuesto es 3.
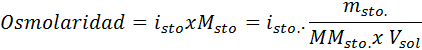
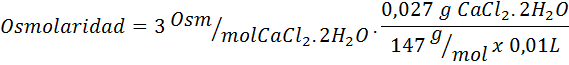
5. Ejemplo 5
¿Qué masa de cloruro de sodio se necesita para preparar 3 litros de una solución cuya osmolaridad sea de 1,20 Osm/L?
Solución: En este caso, como se pide la masa de soluto y tenemos el volumen y la concentración, basta con despejar la masa de la fórmula de osmolaridad.