Sulfato de hierro (FeSO4): estructura, propiedades, síntesis
El sulfato de hierro es una sal inorgánica cuya fórmula química es FeSO4. Consiste de un sólido cristalino de un color variable, obtenido industrialmente como un producto secundario del procesamiento del acero.
Se encuentra en la naturaleza bajo diferentes formas, siendo la más común el sulfato ferroso heptahidratado, FeSO4·7H2O (“vitriolo verde”, presente en el mineral melenterita). Este hidrato se distingue fácilmente por el color verde azuloso de sus cristales (imagen inferior). Otros hidratos tienen por fórmula general FeSO4·xH2O, donde x varía de 1 a 7.

El sulfato ferroso heptahidratado pierde moléculas de agua por calentamiento y puede transformarse en otras formas de sulfato ferroso; así, cuando se calienta a 57 ºC, pierde tres moléculas de agua y se transforma en el sulfato ferroso tetrahidratado. ¿Cuántas en total puede perder? Siete moléculas de agua, es decir, demasiada agua.
El sulfato ferroso se utiliza en el tratamiento y prevención de la anemia por deficiencia de hierro. Empero, puede tener efectos tóxicos, por lo que hay que ser cuidadoso en su dosificación.
Por otro lado, esta sal de hierro tiene numerosos usos y aplicaciones que incluyen la coloración de material textil y cuero; agente reductor químico; dosímetro de radiación; agente conservante de la madera. Asimismo se utiliza en la prevención de la clorosis en las plantas, y en procesos de grabado y litografía.
El FeSO4 puede oxidarse en el aire a sulfato de hierro (III), Fe2(SO4)3 a una velocidad que puede incrementarse por la temperatura, la luz o una elevación del pH.
Muchas de las propiedades físicas y químicas del sulfato ferroso, tales como la solubilidad en agua, el punto de fusión, el tipo de cristales que forma y la densidad, dependen del número de moléculas agua incorporadas en los cristales; es decir, de sus hidratos.
Índice del artículo
- 1 Estructura del sulfato de hierro
- 2 Propiedades físicas y químicas
- 3 Síntesis
- 4 Riesgos
- 5 Usos
- 6 Referencias
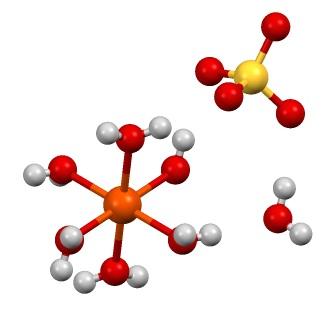
La fórmula química FeSO4 resalta que esta sal se compone de iones Fe2+ y SO42- en una proporción 1:1. Ambos iones interactúan mediante fuerzas electrostáticas de tal manera que se ordenan en un sistema cristalino ortorrómbico; el cual, lógicamente, corresponde a la sal anhidra.
En la imagen superior, por otra parte, se muestra la estructura del FeSO4·7H2O. La esfera anaranjada representa el catión Fe2+, que como se aprecia, se coordina con seis moléculas de agua para formar un octaedro. La carga del Fe2+ atrae el anión SO42-, y este a su vez, si se observa, forma un puente de hidrógeno con la séptima molécula de agua.
La séptima molécula de agua (la que se encuentra distante del octaedro), asimismo forma otro puente de hidrógeno con otra molécula de agua perteneciente a un octaedro vecino. El resultado de estas interacciones es que el cristal pasa de ser ortorrómbico a monoclínico.
A medida que los cristales del FeSO4 anhidro se van hidratando, los aniones SO42- entorno al Fe2+ son sustituidos por moléculas de H2O. Estas sustituciones perturban a los electrones d del hierro, obligándoles a transitar por diferentes niveles de energías; los cuales, son responsables de los cambios de coloración entre blanco, a verde azulado.
Algunos aniones SO42- pueden protonarse producto del medio ácido. Como consecuencia, dentro de los cristales de FeSO4·7H2O puede haber moléculas de H2SO4 si el pH es muy ácido; y por tanto, tocar estos hermosos cristales en dichas condiciones puede ocasionar serias quemaduras.
Sulfato ferroso o sulfato de hierro (II)
-Sulfato ferrroso anhidro (FeSO4)
-Sulfato ferroso heptahidrato (FeSO4.7H2O)
Varía con el grado de hidratación del sulfato. Por ejemplo, el sulfato de hierro heptahidrato tiene un peso molecular de 278,02 g/mol; mientras que el anhidro tiene un peso molecular de 151,91 g/mol.
También varía con el grado de hidratación. Por ejemplo, la forma anhidra presenta cristales blancos ortorrómbicos; mientras que en la forma heptahidra, los cristales son azules-verduzcos monoclínicos.
Inodoro
El sulfato ferroso anhidro es la forma de la sal más densa (3,65 g/cm3). La forma heptahidratada, por otra parte, es la menos densa (1,895 g/cm3).
Igualmente, este varía en función del grado de hidratación. La forma anhidra tiene un punto de fusión de 680 ºC (1.856 ºF, 973 K) y la forma heptahidrata, 60-64 ºC (140-147 ºF, 333-337 K).
-Forma monohidrata: 44,69 g/100 ml de agua (77 ºC)
-Forma heptahidrata 51,35 g/100 ml de agua (54 ºC).
Insoluble.
1,95 kPa (forma heptahidrata)
1,591 (monohidrata) y 1,471 (heptahidrata).
En el aire puede oxidarse rápidamente y se cubre con un color amarillo-marrón, el cual indica la presencia del catión Fe3+. La velocidad de oxidación se incrementa por la adición de álcali o por la exposición a la luz.
Cuando se calienta a descomposición emite vapores tóxicos de dióxido de azufre y trióxido de azufre, dejando como residuo un óxido de hierro rojizo.
Es un agente reductor que actúa sobre el ácido nítrico reduciéndolo a monóxido de nitrógeno. Asimismo, reduce el cloro a cloruro, y las formas tóxicas del cromo presentes en el cemento a cromo (III), de menor toxicidad.
El sulfato ferroso es producido haciendo reaccionar el acero (Fe) con ácido sulfúrico. En el método descrito se sigue el procedimiento siguiente: el acero se usa bajo la forma de lana de acero, la cual se desgrasa previamente con acetona.
Después, se coloca la lana de acero en un beaker de vidrio y se recubre totalmente con ácido sulfúrico 30-40 %, dejando que la digestión ácida ocurra durante varias horas; hasta que la lana de acero desaparezca. Se puede agregar más lana de acero y repetir el procedimiento varias veces.
Los cristales verdes que puedan haberse formado, son redisueltos usando agua acidificada a pH 1-2 con ácido sulfúrico. Esta solución se filtra sobre papel de filtro, y el pH se ajusta mediante la adición de carbonato de sodio. La solución es guardada, para evitar su contacto con el oxígeno, y así desfavorecer la oxidación del Fe2+ a Fe3+
Posteriormente, el filtrado se somete a evaporación a una temperatura comprendida entre 80-90 ºC. El procedimiento se realiza en cápsulas de Pietri colocadas sobre una plancha de calentamiento. Luego, se recogen los cristales verdes formados, los cuales pueden ser llevados a un desecador para completar su deshidratación.
También es producido el sulfato ferroso por oxidación de la pirita (FeS2).
2 FeS2 + 7 O2 + 2 H2O => 2 FeSO4 + 2 H2SO4
La inhalación del FeSO4 provoca irritación en la nariz, la garganta y los pulmones. Si se tiene contacto físico con esta sal puede producir irritación de la piel y los ojos; además, el contacto prolongado con los últimos, puede causar en ellos una mancha parduzca y un daño ocular.
La ingesta repetida puede causar náuseas, vómitos, dolor estomacal, constipación y movimientos intestinales irregulares.
Entre los signos de una intoxicación con sulfato ferroso, se encuentran los siguientes: heces negras o sanguinolentas; piel y uñas azuladas; cambios en el volumen de orina excretado; desmayos; sequedad bucal o de los ojos; dolor pectoral; coma; dificultad respiratoria.
Además, pueden producirse latidos rápidos e irregulares, incremento en la sed y en el hambre, palidez inusual, y acortamiento de la respiración.
La alteración de la coagulación es un indicio del envenenamiento con sulfato ferroso, observándose una prolongación en los tiempos de trombina, protrombina y el tiempo de tromboplastina parcial.
Los estudios realizados sobre el efecto del sulfato ferroso sobre músculos aislados del corazón de conejos, permitió observar que producía una reducción en la tensión máxima desarrollada por los músculos cardíacos estudiados, así como la velocidad máxima de desarrollo de la tensión.
-Se usa como pesticida para controlar la pizca del trigo y la descomposición de los árboles frutales.
-Se emplea en el tratamiento de la clorosis, enfermedad que se caracteriza por el color amarillento de las hojas, causado por la alcalinidad de los suelos.
-El sulfato ferroso controla la alcalinidad, disminuyendo el pH de los suelos.
– Elimina el musgo y acondiciona el césped.
Dentro de los usos del FeSO4 como reactivo y en la industria se tienen los siguientes:
-Reactivo analítico
-Materia cruda para la obtención de la ferrita y el óxido de hierro magnético
-Ingrediente para la elaboración del pigmento azul inorgánico
-Reactivo reductor del ácido nítrico, el cloro y el cromo
-En la fabricación de otros sulfatos
-Se emplea en los baños de galvanoplastia con hierro
-Conservante de la madera
-En aguafuertes de aluminio
-Análisis cualitativo de nitratos (prueba del amarillo marrón por oxidación del Fe2+)
-Catalizador de polimerización
-Se usa como precursor de la síntesis de otros hierros
-Se utiliza industrialmente como fijador de tinte
-En la fabricación del tinte de hierro
-Mordiente en la tinción de la lana
-Para darle color plateado a la madera de arce
-Catalizador de hierro en la reacción de Fenton
Se emplea en el tratamiento de la anemia por deficiencia de hierro, usándose una dosis de 150-300 mg de sulfato ferroso, tres veces por día, lo cual produce un aumento perceptible de la concentración de hemoglobina en una semana de tratamiento.
También ha sido recomendado su uso en mujeres embarazadas como suplemento de su alimentación. El sulfato ferroso ha sido utilizado como astringente en la cicatrización de heridas del ganado.
Se emplea en el tratamiento de las aguas residuales mediante floculación y también, para la eliminación del fosfato de estas aguas. El sulfato ferroso heptahidrato se emplea en la identificación de los tipos de hongos.
- CR Scientific. (s.f.). Lab preparation of ferrous sulfate. Recuperado de: crscientific.com
- Werner H. Baur. (1964). On the crystal chemistry of salt hydrates. III. The determination of the crystal structure of FeSO4.7H2O (melanterite). Acta Cryst. doi.org/10.1107/S0365110X64003000
- PubChem. (2019). Ferrous sulfate heptahydrate. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Marks Lynn. (19 de diciembre de 2014). What Is Ferrous Sulfate (Feosol)? Every Health. Recuperado de: everydayhealth.com
- Wikipedia. (2019). Iron (II) sulfate. Recuperado de: en.wikipedia.org
