Carbonato de sodio (Na2CO3): estructura, propiedades, usos
¿Qué es el carbonato de sodio?
El carbonato de sodio (Na2CO3) es una sal inorgánica de sodio, de metal alcalino y del ácido carbónico. También se le conoce mundialmente como ceniza de sosa. Los lagos y las actividades volcánicas enriquecieron de sodio los suelos, de los cuales se nutrieron las plantas; luego, tras un incendio, estas plantas esparcían las cenizas de carbonato.
¿Cómo surge esta sal del sodio metálico? El sodio puro tiene una configuración de valencia [Ne]3s1. El electrón del orbital 3s1 es fácilmente desprendido por otros elementos de la naturaleza (como el azufre, oxígeno, cloro, flúor, etc.), formando compuestos minerales en donde participa el ion estable Na+.
El Na+ es acompañado por otras especies iónicas en estos sólidos; de estos, el carbonato de sodio es solo uno más presente en la naturaleza. Desde entonces ha tenido uso en todas las civilizaciones a lo largo de los tiempos. Estas civilizaciones fueron encontrando en ese polvo blanco grisáceo propiedades benéficas para sus hogares y sus gentes.
Estas propiedades marcaron sus usos, los cuales mantienen hoy en día aspectos tradicionales del pasado, y otros se acomodan a las necesidades actuales.
El carbonato de sodio es muy abundante en la naturaleza, y quizás también en otros territorios ajenos al planeta Tierra, como algunas de las lunas del sistema solar.
Fórmula
La fórmula química del carbonato de sodio es Na2CO3. ¿Cómo se interpreta? Significa que, en el sólido cristalino, por cada ion CO32– hay dos iones Na+.
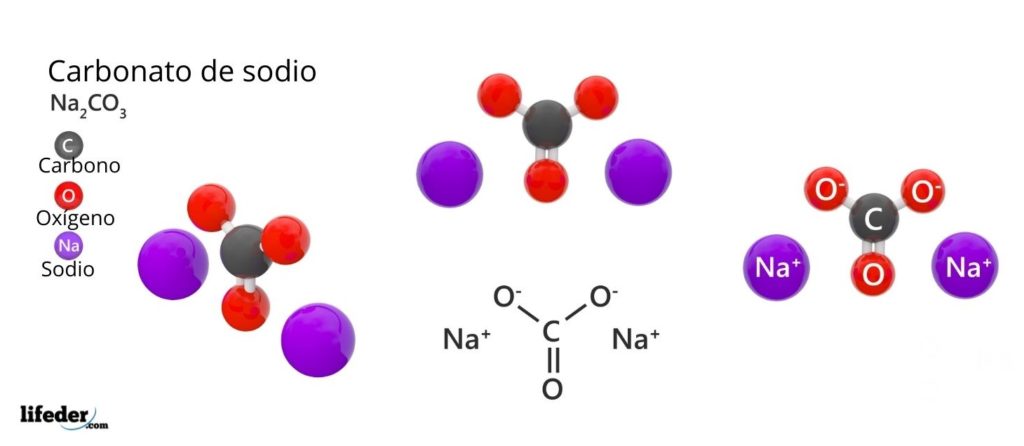
Estructura del carbonato de sodio
En la imagen superior está representada la estructura del Na2CO3 anhídrido (también llamado sosa calcinada). Las esferas púrpuras corresponden a los iones Na+, mientras que las negras y rojas a los iones CO32–.
Los iones carbonatos tienen una estructura trigonal plana, con los átomos de oxígeno en sus vértices.
La imagen otorga un panorama visto desde un plano superior. Los iones Na+ están rodeados de seis átomos de oxígeno, provenientes de los iones CO32–. Es decir, en el Na2CO3 anhídrido el sodio se encuentra con una geometría de coordinación octaédrica (está encerrado en el centro de un octaedro).
Sin embargo, esta estructura también es capaz de alojar moléculas de agua, interaccionando por puentes de hidrógeno con los vértices de los triángulos.
De hecho, los hidratos del Na2CO3 (Na2CO3·10H2O, Na2CO3·7H2O, Na2CO3·H2O, y otros) son de mayor abundancia que la sal anhídrida.
La termonatrita (Na2CO3·H2O), el natrón (Na2CO3·10H2O) y la trona (Na3(HCO3)(CO3)·2H2O son las principales fuentes naturales del carbonato de sodio, en especial el mineral trona, representado en la primera imagen.
Usos/aplicaciones del carbonato de sodio
El carbonato de sodio cumple numerosas funciones en las personas, los hogares y la industria, entre estas funciones destacan las siguientes:
- El carbonato de sodio es utilizado en numerosos productos de limpieza. Esto es debido a su capacidad desinfectante, su poder de disolver las grasas y su propiedad de suavizar el agua. Forma parte de detergentes utilizados en lavanderías, lavaplatos automáticos, limpia vidrios, removedores de manchas, blanqueadores, etc.
- El desinfectante carbonato puede ser utilizado en superficies duras no rugosas, tales como pisos, paredes, porcelanas y bañeras, a excepción del fiberglass y el aluminio, que pueden ser rayados por él.
- Se usa en algunos alimentos para evitar el apelmazamiento que pueda ocurrir en estos.
- Está presente en varios productos de cuidado personal, como baños de burbujas, pastas dentales y jabones.
- Se utiliza en la industria del vidrio debido a su capacidad de descomponer los silicatos.
- Se usa en el mantenimiento de las piscinas, donde cumple una función desinfectante y reguladora del pH.
- En los seres humanos se usa terapéuticamente en el tratamiento de la acidez y de la dermatitis.
- En la medicina veterinaria se utiliza en el tratamiento de la tiña y limpieza de la piel.
Síntesis del carbonato de sodio
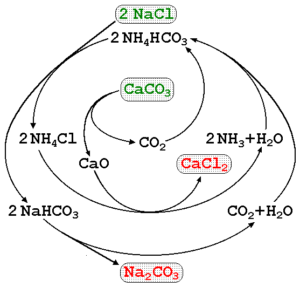
El carbonato de sodio puede fabricarse utilizando salmuera de los mares y piedra caliza (CaCO3) en el proceso Solvay. En la imagen superior está ilustrado un diagrama del proceso señalando las rutas de producción, así como los reactivos, intermediarios y productos. Los reactivos están escritos con letras verdes, y los productos con letras rojas.
El seguimiento de estas reacciones puede resultar un poco intrincado, pero la ecuación global que indica solo los reactivos y productos es:
2NaCl(aq) + CaCO3(s) => Na2CO3(s) + CaCl2(ac)
El CaCO3 tiene una estructura cristalina muy estable, por lo que constantemente demanda mucha energía para descomponerlo en CO2. Además, este proceso genera grandes cantidades de CaCl2 (cloruro de calcio) y otras impurezas, cuyas descargas afectan la calidad de las aguas y el medio ambiente.
Existen también otros métodos de producción del carbonato de sodio en ámbitos industriales, como los procesos Hou y Leblanc.
Hoy en día es sustentable su obtención a partir de sus minerales naturales, siendo la trona el más abundante de estos.
Por otro lado, el método más tradicional consistía en el cultivo y quema de plantas y algas ricas en sodio. Luego, las cenizas eran bañadas con agua y sometidas a calentamiento hasta obtener el producto. De aquí surgieron las famosas cenizas de sosa.
Propiedades del carbonato de sodio
El Na2CO3 es un sólido blanco higroscópico, inodoro, con un peso molecular de 106 g/mol y una densidad de 2,54 g/mL a 25 ºC.
Sus propiedades cambian a medida que incorpora una molécula de agua a su estructura cristalina. Como el agua puede formar puentes de hidrógeno y los iones “abren espacio” entre estos, el volumen del cristal aumenta y la densidad del hidrato disminuye. Por ejemplo, para el Na2CO3·10H2O, su densidad es 1,46 g/mL.
El Na2CO3 funde a 851 ºC, descomponiéndose de acuerdo a la siguiente ecuación:
Na2CO3(s) => Na2O(s) + CO2(g)
Nuevamente, a pesar de que los iones CO32– y Na+ difieren en tamaños, sus interacciones electrostáticas son muy eficientes y mantienen una red cristalina estable.
Las moléculas de agua “entorpecen” estas interacciones y, como resultado de esto, los hidratos son más susceptibles a descomponerse que el anhídrido.
Es una sal básica; es decir, disuelto en agua genera una solución con un pH mayor a 7. Esto se debe a la hidrólisis del CO32–, cuya reacción libera OH– en el medio:
CO32–(ac) + H2O(l) => HCO3–(ac) + OH–(ac)
Es muy soluble en agua y en solventes polares, tales como glicerol, glicerina, acetona, acetatos, y amoníaco líquido.
Referencias
- Shiver & Atkins. (2008). Química Inorgánica. En Los elementos del grupo 1. (Cuarta edición., pág. 265). Mc Graw Hill.
- scifun.org. (2018). Sodium Hydrogen Carbonate & Sodium Carbonate. Recuperado de scifun.org
- Wikipedia. (2018). Sodium carbonate. Recuperado de en.wikipedia.org
- PubChem. (2018). Sodium Carbonate. Recuperado de pubchem.ncbi.nlm.nih.gov
- Ciner Resources Corporation. (2018). Soda Ash. Recuperado de ciner.us.com
- Peltier K. (03 de julio de 2018). Everything You Need to Know About Sodium Carbonite. Recuperado el 08 de abril de 2018, de: thespruce.com
- Net Industries. (2018). Sodium Carbonate – Uses Of Sodium Carbonate. Recuperado el 08 de abril de 2018, de: science.jrank.org
