Cisteína: características, estructura, funciones, biosíntesis
La cisteína (Cys, C) es uno de los 22 aminoácidos encontrados en la naturaleza como parte de las cadenas polipeptídicas que conforman a las proteínas de los seres vivos. Es fundamental para la estabilidad de las estructuras terciarias de las proteínas, pues ayuda a la formación de los puentes disulfuro intramoleculares.
Así como es cierto para otros aminoácidos como la alanina, la arginina, la asparagina, el glutamato y la glutamina, la glicina, la prolina, la serina y la tirosina, los seres humanos somos capaces de sintetizar cisteína, por lo que esta no es considerada como un aminoácido esencial.
A pesar de ello, y en vista de que las tasas de síntesis no siempre abastecen los requerimientos corporales, algunos autores describen a la cisteína como un aminoácido “condicionalmente” esencial.
Este aminoácido fue nombrado por la “cistina”, un componente de los cálculos vesiculares descubierto en 1810, cuyo nombre fue acuñado en 1832 por A. Baudrimont y F. Malaguti. Pocos años después, en 1884, E. Baumann descubrió que la cisteína era el producto de la reducción de la cistina.
Después de los trabajos realizados por Bauman, en 1899, se determinó que la cisteína es el principal constituyente de la proteína que conforma los cuernos de diversos animales, lo que sugirió su posible uso para la síntesis de polipéptidos.
En la actualidad se sabe que la cisteína corporal proviene de los alimentos, del reciclaje de proteínas y de la síntesis endógena, que ocurre principalmente en los hepatocitos.
Índice del artículo
- 1 Características
- 2 Estructura
- 3 Funciones
- 4 Biosíntesis
- 5 Metabolismo y degradación
- 6 Alimentos ricos en cisteína
- 7 Beneficios de la ingesta de cisteína
- 8 Enfermedades relacionadas
- 9 Referencias
La cisteína tiene un peso molecular de 121.16 g/mol y se encuentra, junto con la leucina, la isoleucina, la valina, la fenilalanina, el triptófano, la metionina y la tirosina, entre los aminoácidos más hidrofóbicos.
Pertenece al grupo de los aminoácidos polares sin carga y, como otros aminoácidos, puede ser degradada por hidrólisis alcalina a elevadas temperaturas.
Como el triptófano, la serina, la glicina y la treonina, la cisteína es un precursor metabólico para la gluconeogénesis y la cetogénesis (formación de cuerpos cetónicos).
Este aminoácido existe como parte de la secuencia peptídica de las proteínas, pero también puede hallarse libre en el plasma sanguíneo como disulfuros homogéneos (cistina, un derivado) o mixtos, compuestos por la forma homocisteína-cisteína.
La diferencia principal entre la cisteína libre y la que se encuentra en la estructura proteica es que la primera se encuentra en un estado redox muy oxidado, mientras que la última está usualmente bastante reducida.
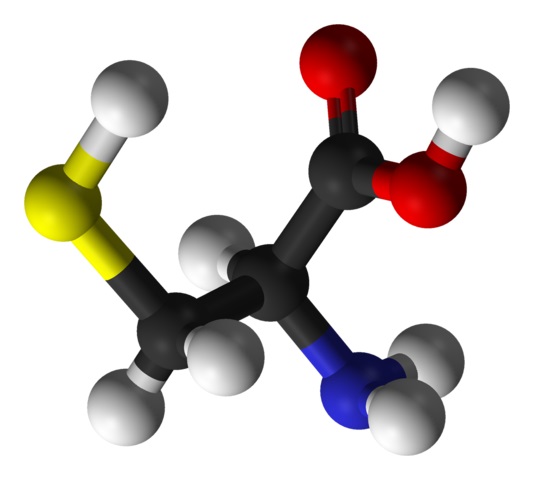
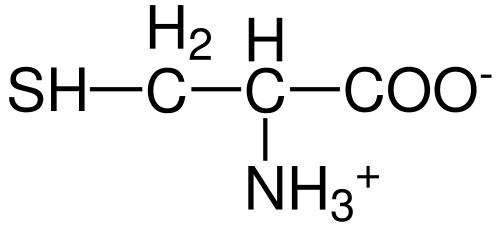
Tal y como ocurre con el resto de los aminoácidos descritos hasta la fecha, la cisteína posee un átomo de carbono central, que es quiral y que se conoce como carbono α.
A este átomo de carbono se unen cuatro especies químicas diferentes:
– un grupo amino (-NH3+)
– un grupo carboxilo (-COO-)
– un átomo de hidrógeno y
– un sustituyente (-R).
El grupo sustituyente es el que le otorga la identidad a cada aminoácido y el de la cisteína se caracteriza por contener un átomo de azufre como parte de un grupo tiol o sulfhidrilo (-CH2-SH).
Es este grupo el que le permite participar en la formación de puentes disulfuro intra- e intermoleculares. Puesto que es un nucleófilo, también puede participar en reacciones de sustitución.
De hecho, esta cadena lateral de la cisteína puede ser modificada para la formación de dos compuestos conocidos como “selenocisteína” y “lantionina”. El primero es un aminoácido que también participa en la formación de proteínas y el segundo es un derivado aminoacídico no proteico.
El grupo tiol de la cisteína también está caracterizado por su gran afinidad a los iones de plata y mercurio (Ag+ y Hg2+).
Las principales funciones de la cisteína en los organismos vivos tienen que ver con su participación en la formación de proteínas. Concretamente, la cisteína participa en el establecimiento de puentes disulfuro, que son esenciales para la formación de la estructura proteica terciaria.
Además, este aminoácido no solo es útil para la síntesis de proteínas, sino que también participa en la síntesis de glutatión (GSH) y proporciona el azufre reducido para la metionina, el ácido lipoico, la tiamina, la coenzima A (CoA), la molibdopterina (un cofactor) y otros compuestos con importancia biológica.
En condiciones de excesiva cantidad de aminoácidos sulfurados, la cisteína y otros aminoácidos relacionados pueden ser empleados para la producción de piruvato y azufre inorgánico. El piruvato logra ser redirigido hacia la ruta gluconeogénica, sirviendo para la producción de glucosa.
Las queratinas, que son uno de los tipos más abundantes de proteínas estructurales en el reino animal, son ricas en residuos de cisteína. Por ejemplo, la lana de ovejas contiene más de 4% de azufre proveniente de este aminoácido.
La cisteína también participa en muchas reacciones de óxido-reducción, por lo que forma parte del sitio activo de algunas enzimas.
Al reaccionar con la glucosa, este aminoácido genera productos de reacción que introducen gustos y aromas atractivos a algunas preparaciones culinarias.
La biosíntesis de los aminoácidos en el cuerpo humano y en el de otros animales (mamíferos y no mamíferos) tiene lugar de forma tejido- y célula-específica; es un proceso que amerita energía y usualmente está separado entre diferentes órganos.
El hígado es uno de los principales órganos involucrados en la síntesis de la mayor parte de los aminoácidos no esenciales, independientemente de la especie que se considere.
En este no solo se sintetiza la cisteína, sino también el aspartato, la asparagina, el glutamato y la glutamina, la glicina, la serina, la tirosina y otros a partir de sus precursores aminoacídicos específicos.
En 1935, Erwin Brand determinó que la cisteína, en los mamíferos, es sintetizada naturalmente a partir de la metionina, lo que tiene lugar exclusivamente en el tejido hepático.
Este proceso puede ocurrir por una “transmetilación” de la metionina, donde los grupos metilo son transferidos a la colina y la creatina. No obstante, la cisteína también puede formarse a partir de la metionina gracias a una trans-sulfuración.
Posteriormente se demostró que, además de la metionina, algunos compuestos sintéticos como la N-acetil cisteína, la cisteamina y la cistamina, son precursores útiles para síntesis de cisteína.
En el caso de la N-acetil cisteína, esta es tomada por las células, donde es convertida a cisteína por una enzima deacetilasa en el citosol.
El mecanismo de síntesis de la cisteína a partir de metionina más conocido es el de la trans-sulfuración. Esto ocurre principalmente en el hígado, pero también se ha determinado en el intestino y el páncreas.
Esto ocurre a partir de la homocisteína, un compuesto derivado del aminoácido metionina; y la primera reacción de esta ruta biosintética es una condensación catalizada por la enzima cistationina β-sintasa (CBS).
Dicha enzima representa el paso de “compromiso” de la ruta y condensa una homocisteína con un residuo de serina, otro aminoácido proteico, lo que produce cistationina. Posteriormente, este compuesto es “cortado” o “escindido” por la enzima cistationasa, lo que conlleva a la liberación de cisteína.
La regulación de la actividad enzimática CBS está mediada por la disponibilidad de metionina y por el estado redox de la célula donde ocurre este proceso.
A través de la ruta de síntesis de cisteína, las células pueden manejar el exceso de metionina, pues su conversión a cisteína es un proceso irreversible.
En estos organismos, la cisteína es sintetizada principalmente a partir de azufre inorgánico, que es la fuente más abundante de azufre utilizable en la biósfera aeróbica.
Este es tomado, ingresa a las células y es luego reducido a sulfuro (S2-), que es incorporado a la cisteína de forma similar a lo que ocurre con el amonio en la síntesis del glutamato o la glutamina.
El catabolismo la cisteína ocurre principalmente en las células hepáticas (hepatocitos), aunque también puede ocurrir en otro tipo de células como las neuronas, las células endoteliales y las células musculares lisas de la vasculatura corporal.
Ciertos defectos en el catabolismo de la cisteína producen una enfermedad hereditaria conocida como la “cistinuria”, caracterizada por la presencia de cálculos de cistina en los riñones, la vejiga y el uréter.
La cistina es un aminoácido derivado de la cisteína y los cálculos se forman por la unión de dos moléculas de estas a través de sus átomos de azufre.
Parte del metabolismo de la cisteína resulta en la formación de ácido cientínsulfínico, a partir del cual se forma la taurina, un aminoácido no-proteico. La reacción es catalizada por la enzima cisteína dioxigenasa.
Adicionalmente, la cisteína puede ser oxidada por el formaldehído para producir N-formil cisteína, cuyo procesamiento posterior puede llevar a la formación de “mercapturato” (producto de la condensación de cisteínas con compuestos aromáticos).
En los animales, la cisteína también es empleada, así como el glutamato y la glutamina, para la síntesis de la coenzima A, de glutatión (GSH), de piruvato, de sulfato y de ácido sulfhídrico.
Uno de los métodos para la conversión de cisteína a piruvato ocurre en dos pasos: el primero implica la remoción del átomo de azufre y el segundo una reacción de transaminación.
Los riñones se encargan de la excreción de los sulfatos y los sulfitos derivados del metabolismo de compuestos sulfurados como la cisteína, mientras que los pulmones exhalan dióxido de azufre y ácido sulfhídrico.
El glutatión, una molécula formada por tres residuos aminoacídicos (glicina, glutamato y cisteína) es una molécula que está presente en las plantas, los animales y las bacterias.
Tiene propiedades especiales que lo hacen un excelente “buffer” redox, pues protege a las células de diferentes tipos de estrés oxidativo.
La cisteína es encontrada naturalmente en alimentos que contiene azufre tal y como las yemas (amarillas) de los huevos, los pimientos rojos, el ajo, las cebollas, el brócoli, la coliflor, la col rizada y las coles de Bruselas, los berros y las hojas de mostaza.
También está presente mayoritariamente en los alimentos ricos en proteínas como las carnes, las legumbres y los lácteos, entre los que destacan:
– Carne de vaca, de cerdo, de pollo y de pescado
– Avena y lentejas
– Semillas de girasol
– Yogurt y queso
Se considera que su ingesta previene la caída del cabello y estimula su crecimiento. En la industria alimenticia es muy empleada como agente mejorador de masas panificables y también para “reproducir” los sabores similares a la carne.
Otros autores han reseñado que la ingesta de suplementos dietéticos o alimentos ricos en cisteína disminuye las lesiones bioquímicas ocasionadas por el consumo excesivo de alimentos contaminados con elementos metálicos, puesto la misma participa en reacciones de “quelación”.
Algunos suplementos nutricionales relacionados con la cisteína son empleados por los seres humanos como antioxidantes, lo que se considera beneficioso desde el punto de vista del “retardo” del envejecimiento.
La N-acetil cisteína (un precursor en la síntesis de la cisteína) por ejemplo, es tomada como suplemento nutricional, pues ello resulta en un incremento de la biosíntesis del glutatión (GSH).
Existen algunas publicaciones científicas que relacionan elevados niveles de cisteína plasmática con la obesidad y otras patologías relacionadas como enfermedades cardiovasculares y otros síndromes metabólicos.
La cistinuria, como se comentó anteriormente, es una patología que se relaciona con la presencia de piedras de cistina, un derivado de la cisteína, debido a un defecto genético en la reabsorción renal de los aminoácidos dibásicos como la cistina.
La deficiencia de cisteína ha sido relacionada con el estrés oxidativo, pues esta es uno de los precursores principales para la síntesis de glutatión. Por lo tanto, deficiencias en este aminoácido pueden conllevar a un envejecimiento prematuro y a todos los bemoles que ello significa.
Se ha demostrado experimentalmente que la suplementación con cisteína mejora las funciones del músculo esquelético, disminuye la relación entre la masa corporal grasa y no grasa, disminuye los niveles plasmáticos de citoquinas inflamatorias, mejora las funciones del sistema inmune, etc.
A mediados de la década de 1990, algunos estudios sugirieron que el Síndrome de Inmunodeficiencia Adquirida (SIDA) podría ser consecuencia de una deficiencia de cisteína inducida por el virus.
Estas afirmaciones estuvieron apoyadas en el hecho de que los pacientes VIH-positivos examinados poseían bajos niveles de cistina y cisteína plasmático, además de concentraciones intracelulares reducidas de glutatión.
- Dröge, W. (1993). Cysteine and Glutathione Deficiency in AIDS Patients: A Rationale for Treatment with N-Acetyl-Cysteine. Pharmacology, 46, 61–65.
- Dröge, W. (2005). Oxidative stress and ageing: Is ageing a cysteine deficiency syndrome? Philosophical Transactions of the Royal Society B: Biological Sciences, 360(1464), 2355–2372.
- Elshorbagy, A. K., Smith, A. D., Kozich, V., & Refsum, H. (2011). Cysteine and obesity. Obesity, 20(3), 1–9.
- Kredich, N. (2013). Biosynthesis of cysteine. EcoSal Plus, 1–30.
- McPherson, R. A., & Hardy, G. (2011). Clinical and nutritional benefits of cysteine-enriched protein supplements. Current Opinion in Clinical Nutrition and Metabolic Care, 14, 562–568.
- Mokhtari, V., Afsharian, P., Shahhoseini, M., Kalantar, S. M., & Moini, A. (2017). A review on various uses of N-acetyl cysteine. Cell Journal, 19(1), 11–17.
- Piste, P. (2013). Cysteine-master antioxidant. International Journal of Pharmaceutical, Chemical and Biological Sciences, 3(1), 143–149.
- Quig, D. (1998). Cysteine metabolism and metal toxicity. Alternative Medicine Review, 3(4), 262–270.
- Wu, G. (2013). Amino acids. Biochemistry and Nutrition. Boca Raton, FL: Taylor & Francis Group.
