Definición de proteína integral
 Las proteínas son las sustancias que constituyen a la materia viva. Estos elementos se componen de aminoácidos (formados, a su vez, por un grupo carboxilo y otro amino).
Las proteínas son las sustancias que constituyen a la materia viva. Estos elementos se componen de aminoácidos (formados, a su vez, por un grupo carboxilo y otro amino).
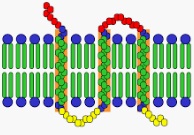
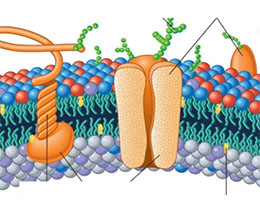
Las proteínas integrales de una membrana plasmática, en este marco, forman parte de la bicapa lipídica. Por eso, si se separan dichas proteínas, la membrana plasmática (también conocida como membrana citoplasmática o membrana celular) sufre la desintegración de su estructura.
Estas proteínas integrales cumplen con diversas funciones, contribuyendo a la adhesión de células y al transporte de materias, por ejemplo. De acuerdo a sus características, es posible diferenciar entre distintos tipos de proteínas integrales.
Existen dos grandes grupos: las proteínas integrales transmembrana y las proteínas integrales no transmembrana. En este segundo conjunto, a su vez, se realizan varias distinciones.
Las proteínas integrales transmembrana atraviesan la totalidad de la bicapa lipídica. Eso no ocurre, por el contrario, con las proteínas integrales no transmembrana. Por otra parte, es posible trazar una separación entre las proteínas integrales y las proteínas periféricas, que están adheridas a la membrana desde el exterior y de manera débil.
Cabe destacar que la membrana plasmática está compuesta por lípidos y proteínas. El 80% de estas proteínas son integrales o intrínsecas, mientras que el resto son periféricas o extrínsecas.
Embebidas en la bicapa lipídica, las proteínas integrales pueden atravesar la membrana celular una o más veces y pueden asomar por una o por las dos caras, o estar unidas a ella a través de enlaces covalentes. Para aislar las proteínas integrales es necesario romper la bicapa lipídica.
Volviendo a las proteínas transmembranales, debemos señalar que existe más de un tipo, y esta clasificación se construye tomando como referencia su estructura. En primer lugar tenemos la unipasos, un tipo de proteína integral que solamente una vez atraviesa la bicapa. A ambos lados de la membrana se encuentran los extremos N-terminal y C-terminal. A este grupo pertenecen, entre otros, las enzimas del Aparato de Golgi y los Receptores-PTK. Uno de los ejemplos más documentados es la glicoforina que encontramos en el eritrocito.
 A su vez, dentro de este tipo de proteína integral, su dominio se puede clasificar en dos grupos diferentes:
A su vez, dentro de este tipo de proteína integral, su dominio se puede clasificar en dos grupos diferentes:
* transmembrana: tiene una estructura secundaria cuya longitud oscila entre los 25 y los 30 aminoácidos y su forma es de hélices alfa. La mayoría de sus residuos laterales son hidrofóbicos (algunos ejemplos son la leucina, la isoleucina y la alanina) porque necesitan interactuar con el contenido de la bicapa a través de fuerzas de Van der Waals e hidrofóbicas. Debemos destacar que dentro de la hélice no hay disponibilidad para su uso como canal. En sus extremos, por otro lado, es posible que haya residuos con carga que se comunican con los fosfolípidos;
* no transmembrana: esta subclase de proteína integral suele ser globular e hidrofílica. Se mantienen por medio de fuerzas electrostáticas y enlaces de hidrógeno, y su longitud puede variar. A veces aparecen cadenas de oligosacáridos y enlaces disulfuro -S-S- en el dominio extracitosólico, algo que no sucede en el dominio citosólico.
El otro grupo grande de proteínas integrales se llama transmembranal multipaso. En este caso, la bicapa lipídica la atraviesan en un mínimo de dos ocasiones, por lo general por medio de varias hélices alfa, aunque a veces presentan láminas beta. Los canales iónicos, las proteínas G triméricas y las porinas en bacterias son tres de los varios ejemplos existentes.
A su vez, éstas se dividen en:
* multipaso en hélice alfa: tienen el mismo número de hélices que la cantidad de veces que cruzan la membrana;
* multipaso en lámina beta: son menos frecuentes que las anteriores y su cantidad de láminas puede ir de ocho a veintidós.
